��Ŀ����
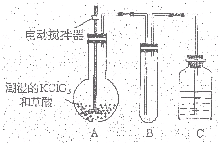 �������ȣ�ClO2����һ�ֻ���ɫ�д̼�����ζ�����壬���۵�Ϊ-59�棬�е�Ϊ11.0�棬������ˮ��ClO2���Կ����������ᣨHClO2�������ᣨHClO3���Ļ����������ҵ�����Գ�ʪ��KClO3�Ͳ��ᣨH2C2O4����60��ʱ��Ӧ�Ƶã�ijѧ��������ͼ��ʾװ��ģ�ҵ��ȡ���ռ�ClO2�����г�������ʡ�ԣ����ش����⣺
�������ȣ�ClO2����һ�ֻ���ɫ�д̼�����ζ�����壬���۵�Ϊ-59�棬�е�Ϊ11.0�棬������ˮ��ClO2���Կ����������ᣨHClO2�������ᣨHClO3���Ļ����������ҵ�����Գ�ʪ��KClO3�Ͳ��ᣨH2C2O4����60��ʱ��Ӧ�Ƶã�ijѧ��������ͼ��ʾװ��ģ�ҵ��ȡ���ռ�ClO2�����г�������ʡ�ԣ����ش����⣺
��1��B���������¶ȿ���װ�ã�Ӧ�����װ����______��AҲ���������¶ȿ���װ�ã����ƾ����⣬����Ҫ��������______��������г���������
��2��C���Լ�Ϊ______��Cװ����ȱ����Ľ����Ľ�����Ϊ______��
��3��A�з�Ӧ������ij���Ρ�ClO2��CO2�ȣ�д����ػ�ѧ����ʽ______��
ClO2�ܲ��ȶ������������ƣ�������ˮ���յõ�ClO2��Һ��Ϊ�ⶨ������Һ��ClO2�ĺ�������������ʵ�飺ȷ��ȡClO2��Һ10mL��ϡ�ͳ�100mL��������ȡV1 mL�������뵽��ƿ�У�����������pH��2.0������������KI���壬����Ƭ�̣��������ָʾ������c mol/L Na2S2O3��Һ�ζ����յ㣬��Ӧԭ����2Na2S2O3+I2��Na2S4O6+2NaI������Na2S2O3��ҺV2mL��
��4���ζ��������������������ƽ�вⶨ��ԭ����______��
��5������ζ��յ�ʱָʾ������ɫ�仯Ϊ______��
��6��ԭClO2��Һ��Ũ��Ϊ______ g/L���ú���ĸ�Ĵ���ʽ��ʾ����
�⣺��1��Ҫ�����¶ȱ���ʹ���¶ȼƲ����¶ȣ���60��ʱ��Ӧ�Ƶã�Ӧ��ˮԡ���ȣ������ձ�����ˮԡ�������������ȵ��۵�ϵͣ�Ϊ�ռ��������ȣ�Ӧ�ڽϵ��¶��½��У�����Ӧ�ò��ñ�ˮԡ��
�ʴ�Ϊ����ˮԡ�� �ձ�����ˮԡ�������¶ȼƣ�
��2��Cװ����β������װ�ã�����NaOH����β����β������ʱװ�ò�������Ƥ������ֹѹǿ����Ӧ��װ���������ͨ���ʴ�Ϊ��NaOH����Һ������װ���������ͨ��
��3������60�棬����غͲ��ᷴӦ����̼��ء�������̼���������Ⱥ�ˮ����Ӧ����ʽΪ��2KClO3+H2C2O4=K2CO3+CO2��+2ClO2��+H2O��
�ʴ�Ϊ��2KClO3+H2C2O4=K2CO3+CO2��+2ClO2��+H2O��
��4��Ϊ����ʵ����Ӧ���ö��ʵ��ķ�����ȡƽ��ֵ���ʴ�Ϊ������żȻ��
��5���ζ��յ�ʱ��I2��ȫ��Ӧ����Һ����ɫ��Ϊ��ɫ���ʴ�Ϊ����ɫ��Ϊ��ɫ��
��6����ԭClO2��Һ��Ũ��Ϊx��
2ClO2��5I2��10Na2S2O3
2mol 10mol
 1��10-3cV2mol
1��10-3cV2mol
x=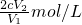 =
=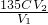 g/L��
g/L��
�ʴ�Ϊ��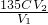 ��
��
��������1�������¶ȵ��������¶ȼƣ��������ȵ��۵�ϵͣ�Ϊ�ռ��������ȣ�Ӧ�ڽϵ��¶��½��У�
��2��Cװ����β������װ�ã�����NaOH����β����β������ʱװ�ò�������Ƥ������ֹѹǿ����
��3�����ݷ�Ӧ�����ͷ�Ӧ����д����Ӧ����ʽ��
��4�����ʵ����Լ�����
��5���ζ��յ�ʱ��I2��ȫ��Ӧ����Һ����ɫ��Ϊ��ɫ��
��6�����ݹ�ϵʽ2ClO2��5I2��10Na2S2O3����c��ClO2����
���������⿼��ʵ�鷽������ƣ�ͬʱ����ѧ���������⡢����������������ȷ���ʵ������ǽⱾ��ؼ����ѶȽϴ�
�ʴ�Ϊ����ˮԡ�� �ձ�����ˮԡ�������¶ȼƣ�
��2��Cװ����β������װ�ã�����NaOH����β����β������ʱװ�ò�������Ƥ������ֹѹǿ����Ӧ��װ���������ͨ���ʴ�Ϊ��NaOH����Һ������װ���������ͨ��
��3������60�棬����غͲ��ᷴӦ����̼��ء�������̼���������Ⱥ�ˮ����Ӧ����ʽΪ��2KClO3+H2C2O4=K2CO3+CO2��+2ClO2��+H2O��
�ʴ�Ϊ��2KClO3+H2C2O4=K2CO3+CO2��+2ClO2��+H2O��
��4��Ϊ����ʵ����Ӧ���ö��ʵ��ķ�����ȡƽ��ֵ���ʴ�Ϊ������żȻ��
��5���ζ��յ�ʱ��I2��ȫ��Ӧ����Һ����ɫ��Ϊ��ɫ���ʴ�Ϊ����ɫ��Ϊ��ɫ��
��6����ԭClO2��Һ��Ũ��Ϊx��
2ClO2��5I2��10Na2S2O3
2mol 10mol
 1��10-3cV2mol
1��10-3cV2molx=
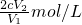 =
=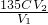 g/L��
g/L���ʴ�Ϊ��
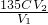 ��
����������1�������¶ȵ��������¶ȼƣ��������ȵ��۵�ϵͣ�Ϊ�ռ��������ȣ�Ӧ�ڽϵ��¶��½��У�
��2��Cװ����β������װ�ã�����NaOH����β����β������ʱװ�ò�������Ƥ������ֹѹǿ����
��3�����ݷ�Ӧ�����ͷ�Ӧ����д����Ӧ����ʽ��
��4�����ʵ����Լ�����
��5���ζ��յ�ʱ��I2��ȫ��Ӧ����Һ����ɫ��Ϊ��ɫ��
��6�����ݹ�ϵʽ2ClO2��5I2��10Na2S2O3����c��ClO2����
���������⿼��ʵ�鷽������ƣ�ͬʱ����ѧ���������⡢����������������ȷ���ʵ������ǽⱾ��ؼ����ѶȽϴ�

��ϰ��ϵ�д�
 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
�����Ŀ
 �������ȣ�ClO2��Ϊһ�ֻ���ɫ���壬�ǹ����Ϲ��ϵĸ�Ч�����ס����١���ȫ��ɱ����������
�������ȣ�ClO2��Ϊһ�ֻ���ɫ���壬�ǹ����Ϲ��ϵĸ�Ч�����ס����١���ȫ��ɱ����������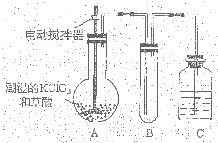 �������ȣ�ClO2����һ�ֻ���ɫ�д̼�����ζ�����壬���۵�Ϊ-59�棬�е�Ϊ11.0�棬������ˮ��ClO2���Կ����������ᣨHClO2�������ᣨHClO3���Ļ����������ҵ�����Գ�ʪ��KClO3�Ͳ��ᣨH2C2O4����60��ʱ��Ӧ�Ƶã�ijѧ��������ͼ��ʾװ��ģ�ҵ��ȡ���ռ�ClO2�����г�������ʡ�ԣ����ش����⣺
�������ȣ�ClO2����һ�ֻ���ɫ�д̼�����ζ�����壬���۵�Ϊ-59�棬�е�Ϊ11.0�棬������ˮ��ClO2���Կ����������ᣨHClO2�������ᣨHClO3���Ļ����������ҵ�����Գ�ʪ��KClO3�Ͳ��ᣨH2C2O4����60��ʱ��Ӧ�Ƶã�ijѧ��������ͼ��ʾװ��ģ�ҵ��ȡ���ռ�ClO2�����г�������ʡ�ԣ����ش����⣺