题目内容
在密闭容器中进行反应CH4(g)+H2O(g) CO(g)+3H2(g) ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是 ( )。
CO(g)+3H2(g) ΔH>0,测得c(CH4)随反应时间(t)的变化如图所示。下列判断不正确的是 ( )。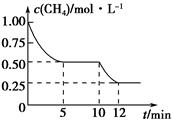
| A.10 min时,改变的外界条件可能是升高温度 |
| B.0~10 min内,v(H2)=0.15 mol·L-1·min-1 |
| C.恒温下,缩小容器体积,一段时间内v(逆)>v(正) |
| D.12 min时,反应达平衡的本质原因是气体总质量不再变化 |
D
解析

练习册系列答案
相关题目
难挥发性二硫化钽(TaS2 )可采用如下装置提纯。将不纯的TaS2 粉末装入石英管一端,抽真空后引入适量碘并封管,置于加热炉中。反应如下: TaS2(g)+ 2I2(g)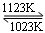 TaI4(g) + S2(g),下列说法错误的是
TaI4(g) + S2(g),下列说法错误的是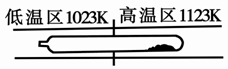
| A.在不同温度区域,TaI4 的量不同 |
| B.在提纯过程中,S2 的量不断增多 |
| C.该反应的平衡常数不随TaI4 和S2 的浓度增大而增大 |
| D.在提纯过程中,I2 的作用是将TaS2 从高温区转移到低温区 |
在25 ℃时,密闭容器中X、Y、Z三种气体的浓度变化情况如图,下列说法错误的是( )。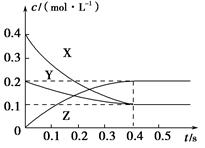
A.反应可表示为3X+Y 2Z 2Z |
| B.从反应开始到0.4 s时,以Y表示的化学反应速率为0.25 mol·L-1·s-1 |
| C.增大压强使平衡向生成Z的方向移动,正逆反应速率均增大 |
| D.升高温度,平衡常数一定增大 |
利用醋酸二氨合铜[Cu(NH3)2Ac]溶液吸收CO,能达到保护环境和能源再利用的目的,反应方程式为Cu(NH3)2Ac+CO+NH3 [Cu(NH3)3]Ac·CO。已知该反应的化学平衡常数与温度的关系如表所示:
[Cu(NH3)3]Ac·CO。已知该反应的化学平衡常数与温度的关系如表所示:
| 温度/℃ | 15 | 50 | 100 |
| 化学平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法正确的是 ( )。
A.上述正反应为吸热反应
B.15 ℃时,反应[Cu(NH3)]Ac·CO
 Cu(NH3)2Ac+CO+NH3的平衡常数为0.5
Cu(NH3)2Ac+CO+NH3的平衡常数为0.5C.保持其他条件不变,减小压强,CO的转化率减小
D.醋酸二氨合铜溶液的浓度大小对CO的吸收没有影响
下列情况下,反应速率相同的是( )
| A.等体积0.1 mol/L HCl和0.05 mol/L H2SO4分别与0.2 mol/L NaOH溶液反应 |
| B.等质量锌粒和锌粉分别与等量1 mol/L HCl反应 |
| C.等体积等浓度HCl和CH3COOH分别与等质量的Na2CO3粉末反应 |
| D.等体积0.2 mol/L HCl和0.1 mol/L H2SO4与等量等表面积等品质石灰石反应 |
在恒容条件下化学反应:2SO2(g)+O2(g) 2SO3(g) ΔH="-Q" kJ·mol-1。在上述条件下分别充入的气体和反应放出的热量(Q)如表所列:
2SO3(g) ΔH="-Q" kJ·mol-1。在上述条件下分别充入的气体和反应放出的热量(Q)如表所列:
根据以上数据,下列叙述正确的是( )
| A.在上述条件下反应生成1 mol SO3固体放热Q/2 kJ | B.2Q3<2Q2=Q1<Q |
| C.Q1=2Q2=2Q3=Q | D.2Q2=2Q3<Q1<Q |
下列条件一定能使反应速率加大的是( )
①增加反应物的物质的量 ②升高温度 ③缩小反应容器的体积 ④不断分离出生成物 ⑤加入MnO2
| A.①②③④⑤ | B.①②⑤ | C.② | D.②③ |
一定温度下,将NO2与SO2以体积比1∶2置于密闭容器中发生NO2(g)+SO2(g) SO3(g)+NO(g) ΔH="-41.8" kJ·mol-1,测得上述反应平衡时NO2与SO2体积比为1∶6,下列说法正确的是( )
SO3(g)+NO(g) ΔH="-41.8" kJ·mol-1,测得上述反应平衡时NO2与SO2体积比为1∶6,下列说法正确的是( )
| A.平衡常数K= |
| B.达到平衡后NO2与SO2的转化率相等 |
| C.SO3和NO的体积比保持不变可以证明达到平衡状态 |
| D.在反应过程中可能存在c(NO2)=c(SO2) |
 2C(g),一段时间后达到平衡,生成n mol C。则下列说法中正确的是( )
2C(g),一段时间后达到平衡,生成n mol C。则下列说法中正确的是( )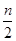 )
)