题目内容
(三选一)【物质结构与性质】
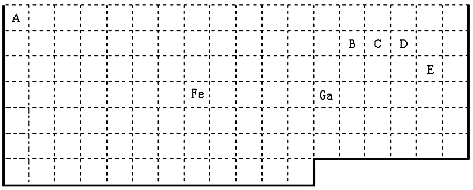
已知A、B、C、D、E五种元素都是元素周期表中前20号元素,原子序数依次增大,E的特征电子排布式为4s2。A、B、C、D四种元素在元素周期表中的相对位置如下表所示。
已知A、B、C、D、E五种元素都是元素周期表中前20号元素,原子序数依次增大,E的特征电子排布式为4s2。A、B、C、D四种元素在元素周期表中的相对位置如下表所示。
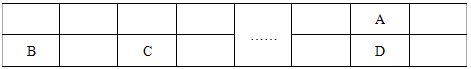
根据以上信息,回答下列问题:
(1)元素C在元素周期表中的位置是__________;D的电子排布式为:____________。
(2)A和D的氢化物中,沸点较高的是_______,原因是__________________;A和B的离子中,半径较小的是__________(填离子符号)。
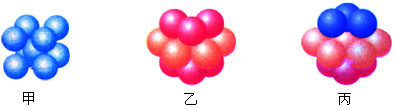
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示(阳离子用“●”表示,位于该正方体的顶点或面心;阴离子用“〇”表示,均位于小正方体中心)。该化合物的电子式是_______________。
(1)元素C在元素周期表中的位置是__________;D的电子排布式为:____________。
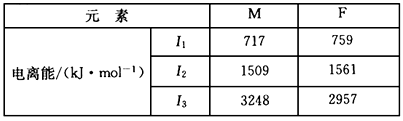
(2)A和D的氢化物中,沸点较高的是_______,原因是__________________;A和B的离子中,半径较小的是__________(填离子符号)。
(3)A和E可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如图所示(阳离子用“●”表示,位于该正方体的顶点或面心;阴离子用“〇”表示,均位于小正方体中心)。该化合物的电子式是_______________。
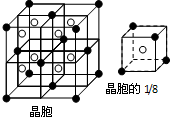
(4)A和E化合物的晶胞1/8的体积为2.0×10-23cm3,求A和E组成的离子化合物的密度,请列式并计算(结果保留一位小数):_______________________________。
(1)第三,ⅢA;1s22s22p63s23p5
(2)A;A的氢化物分子间可以形成氢键,而D的氢化物不能;Na+
(3)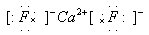
(4)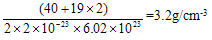
(2)A;A的氢化物分子间可以形成氢键,而D的氢化物不能;Na+
(3)
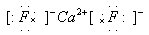
(4)
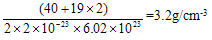

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目