题目内容
【题目】对于恒容密闭容器中发生的可逆反应N2(g)+3H2(g)![]() 2NH3(g) ΔH<0,能说明反应达到化学平衡状态的为
2NH3(g) ΔH<0,能说明反应达到化学平衡状态的为
A. 断开一个N≡N键的同时有6个N—H键生成
B. 混合气体的密度不变
C. 混合气体的平均相对分子质量不变
D. N2、H2、NH3分子数比为1∶3∶2的状态
【答案】C
【解析】试题分析:可逆反应达到化学平衡状态的实质是正逆反应速率相等但不为0。A、断开1个N≡N键的同时,必然会生成2分子氨气,即6个N—H键生成,A不正确;B、密度是气体的质量和容器体积的比值,反应前后气体质量和容器体积均不变,所以在任何时刻混合气体的密度不变,B不正确;C、混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以可以说明达到化学平衡状态,C正确;D、N2、H2、NH3分子数之比1∶3∶2的状态不一定满足正逆反应速率相等,D不正确。答案选C。

【题目】下表各组物质之间通过一步反应不可以实现如图所示转化关系的是

选项 | X | Y | Z |
A | NH3 | NO2 | HNO3 |
B | SiO2 | Na2SiO3 | H2SiO3 |
C | Al2O3 | NaAlO2 | Al(OH)3 |
D | CO2 | Na2CO3 | NaHCO3 |
A. A B. B C. C D. D
【题目】二氧化锆(ZrO2)是最重要的氧离子固体电解质,用于制造燃料电池、氧气含量测定仪等。可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2;含有少量Fe2O3、Al2O3、SiO2杂质)通过如工艺流程法制得。
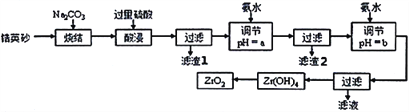
已知:①ZrO2具有两性,高温与纯碱共熔生成可溶于水的Na2ZrO3,与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
请回答下列问题:
(1)已知Zr元素的原子序数是40,请写出它在周期表中的位置:____________________________。
(2)烧结时ZrSiO4发生反应的化学方程式为__________________________;滤渣1的化学式为__________。
(3)调节pH=a时,a的范围应该是__________________;用氨水调节pH=b时,所发生反应的离子方程式为_______________________________________。
(4)本题的流程中,一共有三步过滤操作,北中最后一步过滤所得的Zr(OH)4沉淀需要洗涤,证明该沉淀已经洗涤干净的最佳操作方法是:______________________________________。
(5)工业上用铝热法冶炼锆,写出以ZrO2通过铝热法制取锆的化学方程式:________________。
(6)一种新型燃料电池用掺杂Y2O3的ZrO2晶体作电解质在熔融状态下传导O2-,一极通入空气,另一极通入乙烷,写出负极的电极反应式:________________________________。

