题目内容
在一定温度下,发生如下反应:N2+3H2?2NH3 起始时充入的N2和 H2 的物质的量分别是3.0mol和6.0mol,平衡时,生成NH3的物质的量是2.4mol.已知容器的容积为5.0L,试求:
(1)H2 的转化率.
(2)平衡时混合气体中N2 的体积分数.
(1)H2 的转化率.
(2)平衡时混合气体中N2 的体积分数.
分析:起始时充入的N2和 H2 的物质的量分别是3.0mol和6.0mol,平衡时,生成NH3的物质的量是2.4mol,则
N2+3H2?2NH3
开始3.0 6.0 0
转化1.2 3.6 2.4
平衡1.8 2.4 2.4
以此计算转化率和体积分数.
N2+3H2?2NH3
开始3.0 6.0 0
转化1.2 3.6 2.4
平衡1.8 2.4 2.4
以此计算转化率和体积分数.
解答:解:起始时充入的N2和 H2 的物质的量分别是3.0mol和6.0mol,平衡时,生成NH3的物质的量是2.4mol,则
N2+3H2?2NH3
开始3.0 6.0 0
转化1.2 3.6 2.4
平衡1.8 2.4 2.4
(1)H2的转化率为
×100%=60%,答:H2的转化率为60%;
(2)平衡时混合气体中N2的体积分数为
×100%=27.3%,答:平衡时混合气体中N2的体积分数为27.3%.
N2+3H2?2NH3
开始3.0 6.0 0
转化1.2 3.6 2.4
平衡1.8 2.4 2.4
(1)H2的转化率为
| 3.6mol |
| 6.0mol |
(2)平衡时混合气体中N2的体积分数为
| 1.8mol |
| 1.8mol+2.4mol+2.4mol |
点评:本题考查化学平衡的计算,明确化学平衡三段法计算格式及转化率、体积分数的计算方法即可解答,注意格式规范,题目难度不大.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
|
在一定温度下,发生可逆反应:2A(g)+2B(g)
| |
| [ ] | |
A. |
甲、乙两容器中的反应达到化学平衡时,若向两容器内各充入1 mol氩气,平衡均不移动 |
B. |
甲、乙两容器中的反应达到化学平衡时,C的体积分数相等 |
C. |
向甲容器中再充入2 mol A和2 mol B,平衡后甲中物质C的体积分数不变 |
D. |
向乙容器中再充入2 mol C和6 mol D,平衡后乙中物质C的浓度为原来的2倍 |
 (2011?南开区一模)能源开发、环境保护、资源利用等是当今社会的热门话题.请根据所学化学知识回答下列问题:
(2011?南开区一模)能源开发、环境保护、资源利用等是当今社会的热门话题.请根据所学化学知识回答下列问题: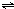 ClO(g)+3H2(g)△H>0.
ClO(g)+3H2(g)△H>0.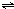 CH3OH(g)△H=-90.1kJ?mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有
CH3OH(g)△H=-90.1kJ?mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有