题目内容
在标准状况下,将224 L HCl气体溶于645 mL (ρ=1.00 g ·cm-3)的水中,所得盐酸的密度为1.20 g ·cm-3。试求:
(1)该盐酸的物质的量浓度。
(2)标准状况下,取这种盐酸100 mL,与足量的NaHCO3溶液反应后,放出多少升气体?气体干燥后,通过盛有足量Na2O2固体的容器,充分反应后,容器内固体增重多少克?
(1)12.0 mol· L-1
(2)26.9 L33.6 g
解析:
(1)n(HCl)=224 L/22.4 L· mol-1=10.0 mol
m(HCl溶液)=635 g+10.0 mol×36.5 g· mol-1=1.00×103g
c(HCl)=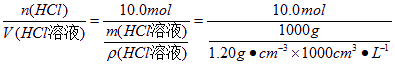 = 12.0 mol · L-1
= 12.0 mol · L-1
(2)HCl+NaHCO3====NaCl+H2O+CO2↑
1 mol 22.4 L
0.100 L×12.0 mol· L-1=1.20 mol V(CO2)
![]()
V(CO2)=22.4 L×1.20 mol÷1 mol=26.9 L
2Na2O2+2CO2====2Na2CO3+O2 固体质量增加
44.8 L 56 g
26.9 L Δm
![]() Δm=33.6 g
Δm=33.6 g
该盐酸的物质的量浓度为12.0 mol·L-1;放出的气体的体积为26.9 L;容器内固体增重33.6 g。

练习册系列答案
 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案
相关题目