题目内容
(13分)在标准状况下,将22.4L HCl 气体溶于63.5mL水中,所得盐酸的密度为1.18g/cm3。
回答下列问题:
(1)所得盐酸的质量分数浓度和物质的量浓度(列式计算)
(2)现需480mL2.0mol/L的盐酸需用量筒量取 mL上述盐酸并选用 mL的容量瓶来配制;若配制过程中洗涤量取上述盐酸的量筒,并将洗涤液转移到容量瓶,则所配盐酸的浓度 2.0mol/L(填>、<或 =)。
(3)现取不纯的Na2CO3样品ag(含少量NaHCO3和H2O)于100mL2.0mol/L过量的盐酸中,充分反应后,再加入50mL1.0mol/L的NaOH溶液后呈中性。蒸发中和后的溶液最终得到固体 g。
(1)(4分) 36.5% 11.8mol/L (只要写成主要量方程计算即可)
(2)(6分) 84.7 ;500 ; > ;(3)(3分) 11.7
【解析】(1)标准状况下,22.4L HCl 气体的物质的量是22.4L÷22.4L/mol=1.0mol,质量是36.5g。所以溶液的质量是63.5g+36.5g=100g,所以溶液的质量分数是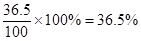 ;溶液的体积是100g÷1.18g/ml=84.75ml,所以浓度是
;溶液的体积是100g÷1.18g/ml=84.75ml,所以浓度是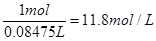 。
。
(2)由于容量瓶的规格没有480ml的,所以应该配制500ml,则需要浓盐酸的体积是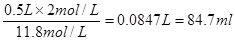 ;若配制过程中洗涤量取上述盐酸的量筒,并将洗涤液转移到容量瓶,则溶质的物质的量将增加,导致浓度偏高。
;若配制过程中洗涤量取上述盐酸的量筒,并将洗涤液转移到容量瓶,则溶质的物质的量将增加,导致浓度偏高。
(3)最终溶液中的溶质是氯化钠,根据钠原子守恒可知,氯化钠的物质的量是0.05L×1.0mol/L=0.05mol,所以质量是0.05mol×58.5g/mol=11.7g。
