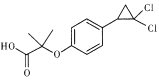
题目内容
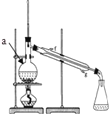
【题目】(1)如图装置(Ⅰ)为以NaOH溶液为电解质溶液的氢氧燃料电池。装置(Ⅰ)中a和b为气体进口,其中a口进入的是(填名称)____________, 写出电极②发生反应的电极反应式_______________
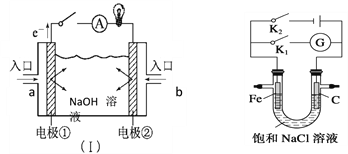
(2)如图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,并在溶液中滴加酚酞
①若闭合K1,铁棒上的电极反应为__________________________
②若闭合K2,铁棒附近观察到的现象是_______________________写出石墨棒上发生的电极反应式____________________________电路中通过0.02 NA个电子时,两极共产生_______ mol气体
【答案】 氢气 O2 +4eˉ+ 2H2O=4 OHˉ Fe -2eˉ=Fe2+ 产生气泡、变红色 2 Clˉ-2eˉ=Cl2 0.02mol
【解析】试题分析:(1)根据装置(Ⅰ)电子流动方向,可知a是负极、b是正极;
(2)如图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,并在溶液中滴加酚酞
①若闭合K1,构成原电池,铁棒为负极;
②若闭合K2,构成电解池,铁棒为阴极。
解析:根据以上分析,(1)装置(Ⅰ)中a是负极失电子发生氧化反应,a通入氢气;电极②通入氧气,得电子发生还原反应,电极反应式O2 +4eˉ+ 2H2O=4 OHˉ;(2)如图,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中,并在溶液中滴加酚酞
①①若闭合K1,构成原电池,铁棒为负极,铁棒上的电极反应为Fe -2eˉ=Fe2+;
②若闭合K2,构成电解池,铁棒为阴极,阴极反应为![]() ,铁棒附近观察到的现象是产生气泡、溶液变红色;石墨棒是阳极,阳极发生的电极反应式2 Clˉ-2eˉ=Cl2;电路中通过0.02 NA个电子时,阳极生成0.01mol氯气、阴极生成0.01mol氢气,两极共产生0.02 mol气体;
,铁棒附近观察到的现象是产生气泡、溶液变红色;石墨棒是阳极,阳极发生的电极反应式2 Clˉ-2eˉ=Cl2;电路中通过0.02 NA个电子时,阳极生成0.01mol氯气、阴极生成0.01mol氢气,两极共产生0.02 mol气体;

 阅读快车系列答案
阅读快车系列答案