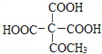题目内容
【题目】如图是一种锂钒氧化物热电池装置,电池总反应为xLi + LiV3O8===Li1+xV3O8。工作时,需先引发铁和氯酸钾反应使共晶盐融化。已知:LiCl-KCl共晶盐熔点为352 ℃。下列说法正确的是( )

A. 整个过程的能量转化只涉及化学能转化为电能
B. 放电时正极反应为Li1+xV3O8- xe-===LiV3O8+ xLi+
C. 放电时Cl-移向LiV3O8电极
D. Li-Si合金熔点高于352 ℃
【答案】D
【解析】A、整个过程的能量转化涉及化学能转化为电能以及化学能和热能之间的转化,选项A错误;B、放电时正极发生得电子的还原反应,即反应为:正极反应式为xLi++LiV3O8+xe﹣═Li1+xV3O8,选项B错误;C、放电时Cl移向负极,移向锂电极,选项C错误;D、根据工作时,需先引发铁和氯酸钾反应使共晶盐融化,得到:Li﹣Si合金熔点高于352℃,选项D正确。答案选D。

 小题狂做系列答案
小题狂做系列答案【题目】回答下列问题:
(1)某二元酸(分子式用H2B表示)在水中的电离方程式是:H2B===H++HB-;HB-![]() H++B2-。在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是________。
H++B2-。在0.1 mol/L的Na2B溶液中,下列粒子浓度关系式正确的是________。
A.c(B2-)+c(HB-)=0.1 mol/L
B.c(B2-)+c(HB-)+c(H2B)=![]() c(Na+)
c(Na+)
C.c(OH-)=c(H+)+c(HB-)
D.c(Na+)+c(OH-)=c(H+)+c(HB-)
(2)下表为几种酸的电离平衡常数
CH3COOH | H2CO3 | H2S |
1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
则pH相同的CH3COONa、Na2CO3、NaHS溶液物质的量浓度由大到小的顺序为________________,少量CO2与NaHS反应的离子方程式为______________。