题目内容
恒温(1100℃)恒容密闭容器中发生反应:Na2SO4(s)+4H2(g)→Na2S(s)+4H2O(g)。下列说法正确的是( )
| A.该反应的平衡常数表达式K=c(H2O)/c(H2) |
| B.若容器内气体的密度或压强保持不变,均说明该反应已达到平衡状态 |
| C.若Na2SO4足量,改变起始充入H2的浓度,达平衡时H2的转化率不变 |
| D.若初始时投入2.84gNa2SO4与一定量H2,反应达平衡时容器内固体共有2.264g,则Na2SO4的转化率为45% |
CD
A错,平衡常数为平衡后生成物浓度幂之积与反应物浓度幂之积的比值;即该反应的平衡常数表达式为K=c4(H2O)/c4(H2),注意在表达式中固体、纯液体不能列入平衡常数表达式中;
B错,若容器内气体的密度保持不变,均说明该反应已达到平衡状态;但压强保持不变不能说明达到平衡状态,因为该反应是等体积反应,每时每刻压强不变;
C正确,该反应为等体积反应,达到等效平衡的条件为投料量成比例即可;
D正确,利用三段法(起始量、变化量、平衡量)及变化量之比=化学计量数之比即可求得。
B错,若容器内气体的密度保持不变,均说明该反应已达到平衡状态;但压强保持不变不能说明达到平衡状态,因为该反应是等体积反应,每时每刻压强不变;
C正确,该反应为等体积反应,达到等效平衡的条件为投料量成比例即可;
D正确,利用三段法(起始量、变化量、平衡量)及变化量之比=化学计量数之比即可求得。

练习册系列答案
 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案
相关题目
 2 SO3反应。几分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90% ,则该反应达到平衡时SO2的转化率为______________。
2 SO3反应。几分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90% ,则该反应达到平衡时SO2的转化率为______________。 ⑴合成氨反应反应:N2(g)+3H2(g)
⑴合成氨反应反应:N2(g)+3H2(g) 2NH3(g),ΔH=-QkJ/mol。若在恒温、恒压条件下向平衡体系中通入氩气,则该化学反应平衡移动 (填“向左”“向右”或“不”);使用催化剂可以加快反应速率,提高合成氨工业的氨气产量,则该反应的ΔH (填“增大”“减小”或“不改变”)。
2NH3(g),ΔH=-QkJ/mol。若在恒温、恒压条件下向平衡体系中通入氩气,则该化学反应平衡移动 (填“向左”“向右”或“不”);使用催化剂可以加快反应速率,提高合成氨工业的氨气产量,则该反应的ΔH (填“增大”“减小”或“不改变”)。 2C B. A+B
2C B. A+B
 2 NH3(g)△H=-92kJ· mol-1若向体积为10L的恒温密闭容器中充入1.2 mol N2和0.6molH 2反应,由图像分析,下列叙述正确的是
2 NH3(g)△H=-92kJ· mol-1若向体积为10L的恒温密闭容器中充入1.2 mol N2和0.6molH 2反应,由图像分析,下列叙述正确的是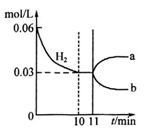
 2AB3(g),当容器中的气体压强不再变化时测得AB2的转化率为80%。已知该温度下上述反应的平衡常数K=2.0×102,则开始时加入B2的物质的量为
2AB3(g),当容器中的气体压强不再变化时测得AB2的转化率为80%。已知该温度下上述反应的平衡常数K=2.0×102,则开始时加入B2的物质的量为 2B(g)(正反应为放热反应)。当反应达到平衡后,改变影响平衡的一个条件,反应达到新的平衡。右图Ⅰ、Ⅱ两曲线分别表示整个反应过程中两种物质的浓度变化关系。下列说法正确的是( )
2B(g)(正反应为放热反应)。当反应达到平衡后,改变影响平衡的一个条件,反应达到新的平衡。右图Ⅰ、Ⅱ两曲线分别表示整个反应过程中两种物质的浓度变化关系。下列说法正确的是( )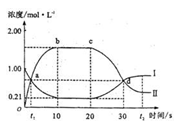
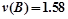 mol/(L·s)
mol/(L·s)