题目内容
在1 L密闭容器中,充入一定量的A发生反应:A(g) 2B(g)(正反应为放热反应)。当反应达到平衡后,改变影响平衡的一个条件,反应达到新的平衡。右图Ⅰ、Ⅱ两曲线分别表示整个反应过程中两种物质的浓度变化关系。下列说法正确的是( )
2B(g)(正反应为放热反应)。当反应达到平衡后,改变影响平衡的一个条件,反应达到新的平衡。右图Ⅰ、Ⅱ两曲线分别表示整个反应过程中两种物质的浓度变化关系。下列说法正确的是( )

 2B(g)(正反应为放热反应)。当反应达到平衡后,改变影响平衡的一个条件,反应达到新的平衡。右图Ⅰ、Ⅱ两曲线分别表示整个反应过程中两种物质的浓度变化关系。下列说法正确的是( )
2B(g)(正反应为放热反应)。当反应达到平衡后,改变影响平衡的一个条件,反应达到新的平衡。右图Ⅰ、Ⅱ两曲线分别表示整个反应过程中两种物质的浓度变化关系。下列说法正确的是( )
| A.a点和d点分别表示两个不同的平衡状态 |
| B.在a点,B的物质的量浓度为0.67 mol/L |
| C.20s~t2s,表示降低温度使平衡移动的过程 |
D.0s~10s间,用B表示的反应速率为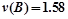 mol/(L·s) mol/(L·s) |
B
本题考查的是化学平衡的有关内容。
A、a点和d点反应混合物的浓度还在发生变化,不是平衡状态,故A错误;
B、a点时,A、B的浓度相等,A的起始浓度为1mol/L,令a点B的浓度为c,根据方程式A(g)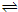 2B(g)可知A的浓度变化为0.5c,所以1mol/L-0.5c=c,解得c=0.67mol/L,故B正确;
2B(g)可知A的浓度变化为0.5c,所以1mol/L-0.5c=c,解得c=0.67mol/L,故B正确;
C、由图可知20s~t2s,B的浓度减小,A的浓度增大.若降低温度使平衡移动,反应为放热反应,降低温度平衡向正反应移动,B的浓度应该增大,A的浓度应增大,故不可能是降低温度,应为升高温度,故C错误;
D、由图可知0s~10s,A的浓度变化为1mol/L-0.21mol/L=0.79mol/L,所以v(A)=
0.079mol/(L?mol),速率之比等于化学计量数之比,所以v(B)=2v(A)=2×0.079mol/(L?mol)=0.158mol/(L?mol),故D错误.
故本题选:B.
A、a点和d点反应混合物的浓度还在发生变化,不是平衡状态,故A错误;
B、a点时,A、B的浓度相等,A的起始浓度为1mol/L,令a点B的浓度为c,根据方程式A(g)
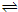 2B(g)可知A的浓度变化为0.5c,所以1mol/L-0.5c=c,解得c=0.67mol/L,故B正确;
2B(g)可知A的浓度变化为0.5c,所以1mol/L-0.5c=c,解得c=0.67mol/L,故B正确;C、由图可知20s~t2s,B的浓度减小,A的浓度增大.若降低温度使平衡移动,反应为放热反应,降低温度平衡向正反应移动,B的浓度应该增大,A的浓度应增大,故不可能是降低温度,应为升高温度,故C错误;
D、由图可知0s~10s,A的浓度变化为1mol/L-0.21mol/L=0.79mol/L,所以v(A)=
| 0.79mol/L |
| 10s |
故本题选:B.

练习册系列答案
相关题目
 2NH3(g) DH=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如图,下列说法正确的是
2NH3(g) DH=-92.4kJ·mol-1,在反应过程中,正反应速率的变化如图,下列说法正确的是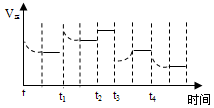
 CH3CH2OH(g)+3H2O(g)。在温度为T℃,容积不变的密闭容器中,将3molH2和1molCO2混合,达到平衡时乙醇气体的体积分数为a,下列有关说法正确的是
CH3CH2OH(g)+3H2O(g)。在温度为T℃,容积不变的密闭容器中,将3molH2和1molCO2混合,达到平衡时乙醇气体的体积分数为a,下列有关说法正确的是 减小
减小 2NH3(g)正反应放热,下列说法错误的是
2NH3(g)正反应放热,下列说法错误的是
 4 C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1,且A的质量分数为w%。保持温度不变,再充入A、B、C的物质的量分别为a、b、c,则下列说法正确的是
4 C(g),达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1,且A的质量分数为w%。保持温度不变,再充入A、B、C的物质的量分别为a、b、c,则下列说法正确的是 量分数小于w%
量分数小于w% 2NH3(g)达到化学平衡状态的标志是
2NH3(g)达到化学平衡状态的标志是
 平均相对分子质量不再改变
平均相对分子质量不再改变 量的2倍
量的2倍