题目内容
用惰性电极电解200mL一定浓度的CuSO4溶液,一段时间后,停止通电.为使溶液恢复到电解前的状态需向溶液中加入9.8gCu(OH)2.则电解后溶液中c(H+)约为( )
分析:根据电解池的工作原理,要想让电解后的电解质复原,则遵循的原则是:出什么加什么,加入 Cu(OH)2后溶液与电解前相同,则溶液中铜离子、氢氧根、氢离子放电.
解答:解:9.8gCu(OH)2的物质的量=
=0.1mol,Cu(OH)2从组成上可看成CuO?H2O,加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH,即电解生成了0.1 mol H2SO4,并消耗0.1 mol H2O,电池反应式为:
2H2O+2CuSO4
2Cu+O2↑+2H2SO4
电解后生成0.1 mol H2SO4,硫酸的物质的量浓度=
=0.5mol/L,氢离子的浓度是硫酸浓度的2倍,所以电解后溶液中c(H+)约为0.5mol/L×2=1mol/L.
故选B.
| 9.8g |
| 98g/mol |
2H2O+2CuSO4
| ||
电解后生成0.1 mol H2SO4,硫酸的物质的量浓度=
| 0.1mol |
| 0.2L |
故选B.
点评:本题考查电解池的工作原理,先计算氢氧化铜的物质的量,再根据氢氧化铜的物质的量计算硫酸的物质的量,从而计算氢离子的浓度.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
常温下用惰性电极电解200 mL 一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如下图所示(以下气体体积已换算成标准状况下的体积),根据图中信息回答下列问题。
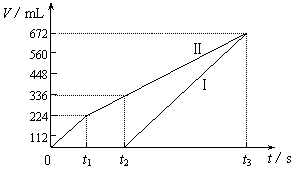 |
⑴通过计算推测:
①原混合溶液NaCl和CuSO4的物质的量浓度;
②t2时所得溶液的pH;
⑵若用惰性电极电解NaCl和CuSO4的混合溶液200mL,经过一段时间后两极均得到224mL气体,则原混合溶液中的氯离子浓度的取值范围为 ,铜离子浓度的取值范围为 。