题目内容
本题分子量用以下数据:H2O=18.0 CaO=56.0 CaO2=72.0过氧化钙是一种安全无毒的氧化物,通常含有部分CaO,且带有数量不等的结晶水.为分析某过氧化物样品的组成,进行了如下实验.
①称取0.270克样品,灼热使之完全分解,生成CaO.O2和H2O,得到的O2在标准状况下的体积为33.6毫升.
②另取0.120克样品,溶于稀盐酸,加热煮沸使生成的H2O2完全分解.然后将溶液中的Ca2+完全转化成CaC2O4沉淀,经过滤洗涤后,将沉淀溶于热的稀硫酸,用0.0200摩/升KMnO4溶液滴定,共用去31.0毫升KMnO4溶液.化学方程式如下:5CaC2O4+2KMnO4+8H2SO4=K2SO4+2MnSO4+5CaSO4+10CO2↑+8H2O
(1)写出CaO2受热分解的化学方程式.
(2)计算样品中的CaO2的质量分数.
(3)计算样品中的CaO2?xH2O的x值.
解:(1)样品灼热使之完全分解生成CaO、O2和H2O,则CaO2受热分解生成CaO和O2,
则反应的方程式为2CaO2 2CaO+O2,
2CaO+O2,
答:CaO2受热分解的化学方程式为2CaO2 2CaO+O2;
2CaO+O2;
(2)
2CaO2 2CaO+O2
2CaO+O2
2×72g 22.4L
m(CaO2) 33.6×10-3L
m(CaO2)=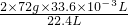 =0.216g,
=0.216g,
w(CaO2)=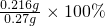 =80%,
=80%,
答:样品中的CaO2的质量分数为80%.
(3)n(KMnO4)=31.0×10-3L×0.0200mol/L=0.00062mol,
5CaC2O4+2KMnO4+8H2SO4=K2SO4+2MnSO4+5CaSO4+10CO2↑+8H2O
5 2
n(CaC2O4) 0.00062mol
n(CaC2O4)=n(Ca2+)=0.00062mol×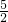 =0.00155mol,
=0.00155mol,
其中CaO2所含的n(Ca2+)=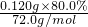 =0.00133mol,
=0.00133mol,
m(CaO)=(0.00155mol-0.00133mol)×56.0g/mol=0.012g
所以:m(H2O)=0.12g-0.012g-0.12g×80%=0.012g,
n(CaO2):n(H2O)=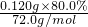 :
: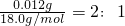
x= .
.
答:品中的CaO2?xH2O的x值为 .
.
分析:(1)由题意可知样品灼热使之完全分解生成CaO、O2和H2O,则CaO2受热分解生成CaO和O2;
(2)根据分解方程式结合生成氧气的体积可计算样品中的CaO2的质量分数;
(3)根据反应5CaC2O4+2KMnO4+8H2SO4=K2SO4+2MnSO4+5CaSO4+10CO2↑+8H2O可知样品中n(Ca2+),结合CaO2的质量分数可求的CaO的质量,进而计算水的质量,根据物质的量可计算x.
点评:本题考查较为综合,涉及混合物的计算,物质的化学式的推断,题目难度较大,注意物质的量应用于化学方程式的计算.
则反应的方程式为2CaO2
 2CaO+O2,
2CaO+O2,答:CaO2受热分解的化学方程式为2CaO2
 2CaO+O2;
2CaO+O2;(2)
2CaO2
 2CaO+O2
2CaO+O22×72g 22.4L
m(CaO2) 33.6×10-3L
m(CaO2)=
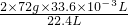 =0.216g,
=0.216g,w(CaO2)=
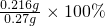 =80%,
=80%,答:样品中的CaO2的质量分数为80%.
(3)n(KMnO4)=31.0×10-3L×0.0200mol/L=0.00062mol,
5CaC2O4+2KMnO4+8H2SO4=K2SO4+2MnSO4+5CaSO4+10CO2↑+8H2O
5 2
n(CaC2O4) 0.00062mol
n(CaC2O4)=n(Ca2+)=0.00062mol×
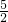 =0.00155mol,
=0.00155mol,其中CaO2所含的n(Ca2+)=
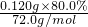 =0.00133mol,
=0.00133mol,m(CaO)=(0.00155mol-0.00133mol)×56.0g/mol=0.012g
所以:m(H2O)=0.12g-0.012g-0.12g×80%=0.012g,
n(CaO2):n(H2O)=
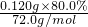 :
: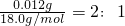
x=
 .
.答:品中的CaO2?xH2O的x值为
 .
.分析:(1)由题意可知样品灼热使之完全分解生成CaO、O2和H2O,则CaO2受热分解生成CaO和O2;
(2)根据分解方程式结合生成氧气的体积可计算样品中的CaO2的质量分数;
(3)根据反应5CaC2O4+2KMnO4+8H2SO4=K2SO4+2MnSO4+5CaSO4+10CO2↑+8H2O可知样品中n(Ca2+),结合CaO2的质量分数可求的CaO的质量,进而计算水的质量,根据物质的量可计算x.
点评:本题考查较为综合,涉及混合物的计算,物质的化学式的推断,题目难度较大,注意物质的量应用于化学方程式的计算.

练习册系列答案
相关题目