题目内容
已知粗盐中含有CaCl2、MgCl2及一些可溶性硫酸盐,请根据你所学的知识,将除杂试剂、所除杂质以及除杂时的化学方程式按照除杂顺序填入下表:
| 试剂加入顺序 | 加入的试剂 | 所除杂质 | 化学方程式 |
| ① | | | |
| ② | | | |
| ③ | | | |
| ④ | | | |
| 加入的试剂 | 所除杂质 | 化学方程式 |
| BaCl2 | 硫酸盐 | BaCl2+Na2SO4====BaSO4↓+2NaCl |
| NaOH | MgCl2 | MgCl2+2NaOH====Mg(OH)2↓+2NaCl |
| Na2CO3 | CaCl2、BaCl2 | BaCl2+Na2CO3====BaCO3↓+2NaCl CaCl2+Na2CO3====CaCO3↓+2NaCl |
| 盐酸 | NaOH溶液、Na2CO3溶液 | NaOH+HCl====NaCl+H2O Na2CO3+2HCl====2NaCl+CO2↑+H2O |
为了使杂质能除得比较干净,所加试剂一般要过量,而试剂过量又出现引入新杂质的问题,为此,加入试剂的顺序要尽可能使前一过量试剂在后续除杂操作中除去。本题中,加入顺序是BaCl2、NaOH、Na2CO3、盐酸。加过量Na2CO3时可除去过量的BaCl2,最后加盐酸除去过量的NaOH、Na2CO3,当溶液达到中性微酸性时,得到几乎不含杂质的氯化钠溶液。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

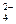 已除尽?方法是________________________________。
已除尽?方法是________________________________。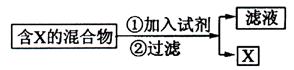
 (1)
(1) ,反应的氧化剂是______________,氧化产物为__________
,反应的氧化剂是______________,氧化产物为__________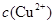 逐渐下降,
逐渐下降,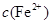 、
、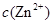 会逐渐增加,所以需定时除去其中的
会逐渐增加,所以需定时除去其中的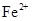 、
、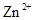 。下表为几种物质的溶度积。
。下表为几种物质的溶度积。
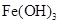
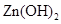
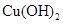
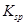
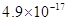
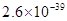
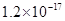
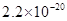
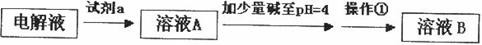
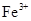 生成
生成