题目内容
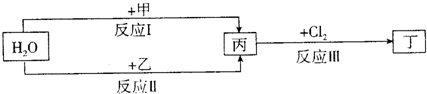
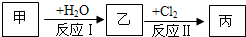
在下列物质转化关系中,反应的条件和部分产物已略去.已知:甲、乙是两种常见金属,反应Ⅲ是工业制备盐酸的反应.

回答下列问题:
(1)反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则该黄色物质的电子式为______,该化合物中存在的化学键有______.
与甲在同一周期的金属元素(包括甲),按单质熔点由高到低的顺序排列依次为______(用元素符号表示).
(2)反应II中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则乙在周期表中的位置是______;反应II的化学方程式为______.
(3)通过比较反应I、II的反应条件,可得出甲的金属性比乙的金属性______(填“强”或“弱”),比较二者金属性强弱的依据是______(写出一种即可).
(4)下列关于第三周期金属元素的单质及其化合物的说法正确的是______(选填答案编号).
a.工业上一般用电解法进行冶炼,获取单质
b.金属阳离子都具有相同的电子排布式
c.氢氧化物都很容易分解得到相应的氧化物
d.金属氯化物都是电解质,都属于离子化合物.
解:反应Ⅲ是工业制备盐酸的反应,丙为H2,丁为HCl,
(1)反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,该物质含有Na元素,故甲为Na,与水反应生成氢氧化钠,氢氧化钠是离子化合物,由钠离子与氢氧根离子构成,电子式为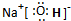 ,钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成极性键,
,钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成极性键,
离子半径Na+>Mg2+>Al3+,离子所带电荷Na+<Mg2+<Al3+,电荷越多、半径越小,金属键越强,熔点越高,故熔点Al>Mg>Na,
故答案为: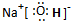 ;离子键、极性键;Al>Mg>Na;
;离子键、极性键;Al>Mg>Na;
(2)反应II中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则乙为Fe,处于周期表中第四周期第Ⅷ族,生成的磁性物质为Fe3O4,反应方程式为:3Fe+4H2O(g) Fe3O4+4H2(g),故答案为:第四周期第Ⅷ族;3Fe+4H2O(g)
Fe3O4+4H2(g),故答案为:第四周期第Ⅷ族;3Fe+4H2O(g) Fe3O4+4H2(g);
Fe3O4+4H2(g);
(3)铁越水蒸气在高温条件下发生反应,钠与水在常温下剧烈反应,故金属性钠比铁强,
最高价氧化物对应水化物碱性强弱比较金属性强弱,NaOH是强碱而Fe(OH)3是弱碱,说明金属性钠比铁强,
故答案为:强;NaOH是强碱而Fe(OH)3是弱碱;
(4)a.Na、Mg、Al都是活泼金属,工业上一般用电解法进行冶炼,故a正确;
b.Na、Mg、Al阳离子核外电子数都是10,具有相同的电子排布式,故b正确;
c.氢氧化钠不易分解,氢氧化镁、氢氧化铝容易分解,故c错误;
d.氯化钠、氯化镁、氯化铝都是电解质,但氯化铝是共价化合物,故d错误;
故答案为:ab.
分析:反应Ⅲ是工业制备盐酸的反应,丙为H2,丁为HCl,
(1)反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,该物质含有Na元素,故甲为Na,与水反应生成氢氧化钠,氢氧化钠是离子化合物,由钠离子与氢氧根离子构成,钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成极性键;
与Na在同一周期的金属含有Mg、Al,金属键越强,熔点越高,影响金属键的因素有离子所带电荷、离子半径,电荷越多、半径越小,熔点越高;
(2)反应II中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则乙为Fe,磁性物质为Fe3O4,据此解答;
(3)金属与水反应,越容易进行,则金属的金属性越强,可以利用金属与酸反应难易程度或最高价氧化物对应水化物碱性强弱比较金属性强弱;
(4)a.Na、Mg、Al都是活泼金属,工业上一般用电解法进行冶炼;
b.Na、Mg、Al阳离子核外电子数都是10,具有相同的电子排布式;
c.氢氧化钠不易分解;
d.氯化铝是共价化合物.
点评:本题以元素推断为载体,考查钠、铁元素单质的性质等、常用化学用语书写、晶体结构与性质等,难度不大,注意基础知识的掌握.
(1)反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,该物质含有Na元素,故甲为Na,与水反应生成氢氧化钠,氢氧化钠是离子化合物,由钠离子与氢氧根离子构成,电子式为
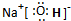 ,钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成极性键,
,钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成极性键,离子半径Na+>Mg2+>Al3+,离子所带电荷Na+<Mg2+<Al3+,电荷越多、半径越小,金属键越强,熔点越高,故熔点Al>Mg>Na,
故答案为:
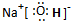 ;离子键、极性键;Al>Mg>Na;
;离子键、极性键;Al>Mg>Na;(2)反应II中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则乙为Fe,处于周期表中第四周期第Ⅷ族,生成的磁性物质为Fe3O4,反应方程式为:3Fe+4H2O(g)
 Fe3O4+4H2(g),故答案为:第四周期第Ⅷ族;3Fe+4H2O(g)
Fe3O4+4H2(g),故答案为:第四周期第Ⅷ族;3Fe+4H2O(g) Fe3O4+4H2(g);
Fe3O4+4H2(g);(3)铁越水蒸气在高温条件下发生反应,钠与水在常温下剧烈反应,故金属性钠比铁强,
最高价氧化物对应水化物碱性强弱比较金属性强弱,NaOH是强碱而Fe(OH)3是弱碱,说明金属性钠比铁强,
故答案为:强;NaOH是强碱而Fe(OH)3是弱碱;
(4)a.Na、Mg、Al都是活泼金属,工业上一般用电解法进行冶炼,故a正确;
b.Na、Mg、Al阳离子核外电子数都是10,具有相同的电子排布式,故b正确;
c.氢氧化钠不易分解,氢氧化镁、氢氧化铝容易分解,故c错误;
d.氯化钠、氯化镁、氯化铝都是电解质,但氯化铝是共价化合物,故d错误;
故答案为:ab.
分析:反应Ⅲ是工业制备盐酸的反应,丙为H2,丁为HCl,
(1)反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,该物质含有Na元素,故甲为Na,与水反应生成氢氧化钠,氢氧化钠是离子化合物,由钠离子与氢氧根离子构成,钠离子与氢氧根离子之间形成离子键,氢氧根离子中氧原子与氢原子之间形成极性键;
与Na在同一周期的金属含有Mg、Al,金属键越强,熔点越高,影响金属键的因素有离子所带电荷、离子半径,电荷越多、半径越小,熔点越高;
(2)反应II中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则乙为Fe,磁性物质为Fe3O4,据此解答;
(3)金属与水反应,越容易进行,则金属的金属性越强,可以利用金属与酸反应难易程度或最高价氧化物对应水化物碱性强弱比较金属性强弱;
(4)a.Na、Mg、Al都是活泼金属,工业上一般用电解法进行冶炼;
b.Na、Mg、Al阳离子核外电子数都是10,具有相同的电子排布式;
c.氢氧化钠不易分解;
d.氯化铝是共价化合物.
点评:本题以元素推断为载体,考查钠、铁元素单质的性质等、常用化学用语书写、晶体结构与性质等,难度不大,注意基础知识的掌握.

练习册系列答案
相关题目