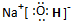题目内容
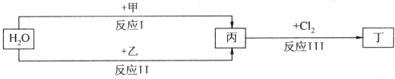
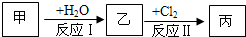
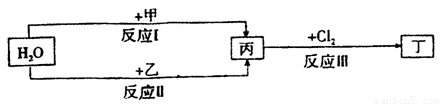
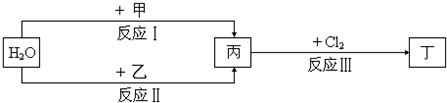
在下列物质转化关系中,反应的条件和部分产物已略去.
回答下列问题:
(1)若甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的反应.
①反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是 .(填字母)
A.热分解法 B.热还原法 C.电解法
②反应Ⅱ中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式是 .
③通过比较反应I、Ⅱ的反应条件,可得出甲的金属性比乙的金属性 (填“强”或“弱”),比较二者金属性强弱的依据还可以是 (写出一种即可)
(2)若甲、乙是化合物,且反应Ⅲ是工业制漂白粉的反应.
①反应Ⅲ的化学方程式是 .
②反应I的另一种产物为有机物,则该有机物的电子式是 .
③在饱和氯水中加块状石灰石,能制得较浓HClO溶液,同时放出一种气体.其反应的离子方程式是 .

回答下列问题:
(1)若甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的反应.
①反应I中,甲在通常条件下和水剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是
A.热分解法 B.热还原法 C.电解法
②反应Ⅱ中,乙与H2O在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式是
③通过比较反应I、Ⅱ的反应条件,可得出甲的金属性比乙的金属性
(2)若甲、乙是化合物,且反应Ⅲ是工业制漂白粉的反应.
①反应Ⅲ的化学方程式是
②反应I的另一种产物为有机物,则该有机物的电子式是
③在饱和氯水中加块状石灰石,能制得较浓HClO溶液,同时放出一种气体.其反应的离子方程式是
分析:(1)①反应I中,甲在通常条件下和A剧烈反应,应为钠和水的反应,生成氢氧化钠和氢气;
②反应Ⅱ中,乙与A在高温下反应,除丙外,还生成一种有磁性的物质,应为铁和水蒸气的反应;
③比较金属性强弱,可根据与水反应的剧烈程度或者最高价氧化物对应水化物的碱性强弱判断;
(2)反应Ⅲ是工业制漂白粉的反应,丙是氢氧化钙,氢氧化钙和氯气反应生成氯化钙、次氯酸钙和水,反应I的另一种产物为有机物,应为碳化钙和水的反应,生成乙炔和氢氧化钙,结合氯水的组成和性质解答该题.
②反应Ⅱ中,乙与A在高温下反应,除丙外,还生成一种有磁性的物质,应为铁和水蒸气的反应;
③比较金属性强弱,可根据与水反应的剧烈程度或者最高价氧化物对应水化物的碱性强弱判断;
(2)反应Ⅲ是工业制漂白粉的反应,丙是氢氧化钙,氢氧化钙和氯气反应生成氯化钙、次氯酸钙和水,反应I的另一种产物为有机物,应为碳化钙和水的反应,生成乙炔和氢氧化钙,结合氯水的组成和性质解答该题.
解答:解:(1))①反应Ⅲ是工业制盐酸的反应,根据元素守恒知,丙是氢气,丁是氯化氢;若甲、乙是两种常见金属,能和水反应的常见金属是铁、钠,焰色反应的物质含有钠元素,钠和水反应生成氢氧化钠和氢气,所以甲是钠,乙是铁,钠是活泼金属,采用电解熔融盐的方法冶炼,故答案为:C;
②通过以上分析知,乙是铁,高温条件下,铁和水反应生成四氧化三铁和氢气,反应方程式为2Fe+4H2O(g)
Fe3O4+4H2,
故答案为:2Fe+4H2O(g)
Fe3O4+4H2;
③根据反应条件知,钠的金属性比铁强,比较金属性强弱的方法还有:与酸反应置换氢气的难易程度、其碱的碱性强弱等,
故答案为:强;NaOH是强碱,Fe(OH)3是弱碱;
(2))①若甲、乙是化合物,且反应Ⅲ是工业制漂白粉的反应,则丙是氢氧化钙,氢氧化钙和氯气反应生成氯化钙、次氯酸钙和水,
反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
②反应I的另一种产物为有机物,应为碳化钙和水的反应,生成乙炔和氢氧化钙,乙炔的电子式为: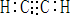 ,
,
故答案为: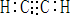 ;
;
③氯水中含有盐酸和次氯酸,在饱和氯水中加块状石灰石,碳酸钙和盐酸反应生成氯化钙、二氧化碳和水,从而能制得较浓HClO溶液,
离子反应方程式为:2Cl2+H2O+CaCO3=Ca2++2Cl-+2HClO+CO2↑,故答案为:2Cl2+H2O+CaCO3=Ca2++2Cl-+2HClO+CO2↑.
②通过以上分析知,乙是铁,高温条件下,铁和水反应生成四氧化三铁和氢气,反应方程式为2Fe+4H2O(g)
| ||
故答案为:2Fe+4H2O(g)
| ||
③根据反应条件知,钠的金属性比铁强,比较金属性强弱的方法还有:与酸反应置换氢气的难易程度、其碱的碱性强弱等,
故答案为:强;NaOH是强碱,Fe(OH)3是弱碱;
(2))①若甲、乙是化合物,且反应Ⅲ是工业制漂白粉的反应,则丙是氢氧化钙,氢氧化钙和氯气反应生成氯化钙、次氯酸钙和水,
反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,故答案为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
②反应I的另一种产物为有机物,应为碳化钙和水的反应,生成乙炔和氢氧化钙,乙炔的电子式为:
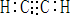 ,
,故答案为:
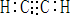 ;
;③氯水中含有盐酸和次氯酸,在饱和氯水中加块状石灰石,碳酸钙和盐酸反应生成氯化钙、二氧化碳和水,从而能制得较浓HClO溶液,
离子反应方程式为:2Cl2+H2O+CaCO3=Ca2++2Cl-+2HClO+CO2↑,故答案为:2Cl2+H2O+CaCO3=Ca2++2Cl-+2HClO+CO2↑.
点评:本题考查无机物的推断,侧重于学生的分析能力和元素化合物知识的综合运用的考查,注意把握物质的性质以及转化关系,结合题给信息进行推断,难度中等.

练习册系列答案
相关题目