题目内容
(8分)甲醇是一种优质燃料,可制作燃料电池。
(1)工业上可用下列两种反应制备甲醇:
①CO(g) + 2H2(g)  CH3OH(g) ΔH1 ②CO2(g)+3H2(g)
CH3OH(g) ΔH1 ②CO2(g)+3H2(g) CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
已知:③2H2(g)+ O2(g) = 2H2O(g) ΔH3。则2CO(g)+O2(g)=2CO2(g) 的反应热
ΔH=______(用ΔH1、ΔH2、ΔH3表示)。
(2)生产甲醇的原料CO和H2来源于:CH4(g) + H2O(g)  CO(g) + 3H2(g) ΔH4。
CO(g) + 3H2(g) ΔH4。
一定条件下CH4的平衡转化率与温度、压强的关系如图a。则ΔH4______0,P1_________P2
(填“<”、“>”或“=”)
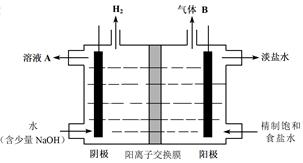
某实验小组设计如图b所示的甲醇燃料电池装置,工作一段时间后,溶液的PH (填增大、 减小、不变)。负极的电极反应式为_______ ____。
(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。粗铜电解得到精铜的的电解池中,阳极材料是 ;阴极材料是 ;阳极泥为:
(1)2△H1-2△H2+△H3; (2)>;<;
(3)减小 CH3OH-6e-+8OH-=CO32-+6H2O(4)粗铜,精铜,Ag、Au
解析试题分析:(1)①×2-②×2+③,整理可得2CO(g)+O2(g)=2CO2(g) ΔH=2△H1-2△H2+△H3;(20由于升高温度,CH4的平衡转化率增大。根据平衡移动原理:升高温度,平衡向吸热反应方向移动,所以正反应方向是吸热反应,ΔH4>0;增大压强,平衡逆向移动,CH4的平衡转化率降低。根据图示可知P1<P2(3)某实验小组设计如图b所示的甲醇燃料电池装置,工作原理是2CH3OH+3O2+4KOH=2K2CO3+6H2O,可见工作一段时间后,溶液的pH减小。负极的电极反应式为CH3OH-6e-+8OH-=CO32-+6H2O。(4)黄铜矿熔炼后得到的粗铜含少量Fe、Ag、Au等金属杂质,需进一步采用电解法精制。粗铜电解得到精铜的的电解池中,阳极材料是粗铜,阴极材料是精铜;在阳极上Cu及活动性比Cu强的金属Fe等失去电子,变为金属阳离子进入溶液,而活动性比Cu弱的金属Ag、Au等就沉淀在阳极底层,俗称阳极泥,所以阳极泥为Ag、Au。
考点:考查盖斯定律的应用、温度、压强对物质转化率的影响、燃料电池的各种原理及电镀的知识。

 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案(15分)甲醇是一种可再生能源,具有广泛的开发和应用前景.请回答下列与甲醇有关的问题.
(1)甲醇分子是____________分子(填“极性”或“非极性”).
(2)工业上一般可采用如下反应来合成甲醇:CO(g)+2H2(g) 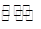 CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
CH3OH(g)△H=﹣86.6KJ/mol,在T℃时,往一个体积固定为1L的密闭容器中加入1mol CO和2mol H2,反应达到平衡时,容器内的压强是开始时的3/5.
①达到平衡时,CO的转化率为____________
②下列选项能判断该反应达到平衡状态的依据的有____________
| A.2v(H2)=v(CH3OH) | B.CO的消耗速率等于CH3OH的生成速率 |
| C.容器内的压强保持不变 | D.混合气体的密度保持不变 |
(3)已知在常温常压下:
①2CH3OH(1)+3O2(g)=2CO2(g)+4H2O(g) △H=﹣akJ·mol﹣1
②2CO(g)+O2(g)=2CO2(g) △H=﹣bkl·mol﹣1
③H2O(g)=H2O(1) △H=﹣ckJ·mol﹣1
则CH3OH(1)+O2(g)==CO(g)+2H2O(1) △H=____________kJ·mol﹣1
(4)由甲醇、氧气和NaOH溶液构成的新型手机电池,可使手机连续使用一个月才充一次电.
①该电池负极的电极反应式为____________________________________.
②若以该电池为电源,用石墨做电极电解200mL含有如下离子的溶液.
| 离子 | Cu2+ | H+ | Cl﹣ | SO42﹣ |
| c/mol·L﹣1 | 0.5 | 2 | 2 | 0.5 |
(7分)在研究化学反应中的能量变化时,我们通常做下面的实验:
在一个小烧杯里,加入20 g已研磨成粉末的Ba(OH)2·8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10 g NH4Cl晶体,根据实验步骤,填写下表,并回答问题。
| 实验步骤 | 实验现象及结论 |
| 将晶体混合,立即快速搅拌 | 有刺激性气味能使湿润的紫色石蕊试纸变蓝的___①__产生 |
| 用手摸烧杯下部 | 感觉烧杯变凉说明此反应是_ ② 反应 |
| 用手拿起烧杯 | 烧杯下面的带有几滴水的玻璃片粘到了烧杯底部 |
| 将粘有玻璃片的烧杯放在盛有热水的烧杯上 | 玻璃片脱离上面烧杯底部 |
| 反应后移走多孔塑料片观察反应物 | 混合物成糊状,证明有_③___生成 |
① ② ③
(2)实验中要立即用玻璃棒迅速搅拌的原因是: __________________。(2分)
(3)在上述实验过程中,为什么用浸有稀硫酸的湿棉花置于多孔塑料板上?(2分)
___________________________________________________________。
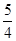 O2(g)=
O2(g)= P4O10(s);Δ H=-738.5KJ·mol-1
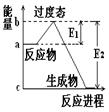
P4O10(s);Δ H=-738.5KJ·mol-1 说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的 总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。
说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的 总能量 (填“大于”、“小于”或“等于”)CO2和NO的总能量。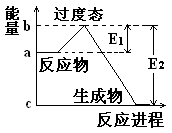
 CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:①此段时间内,用CO2表示的平均反应速率为 ②2 min时,容器内气体的总物质的量为_________.
CO2+NO,2 min时,测得容器中NO的物质的量为0.5 mol ,则:①此段时间内,用CO2表示的平均反应速率为 ②2 min时,容器内气体的总物质的量为_________.  2SO3(g)
2SO3(g) 2SO3(g) △H= 。
2SO3(g) △H= 。
 2NO2(g) △H= -113.0 kJ·mol-1
2NO2(g) △H= -113.0 kJ·mol-1