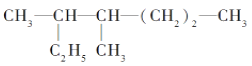题目内容
【题目】A、B、C、D、E、F、G是前四周期(除稀有气体)原子序数依次增大的七种元素,A的原子核外电子只有一种运动状态;B、C的价电子层中未成对电子数都是2;B、C、D同周期;E核外的s、p能级的电子总数相筹;F与E同周期且第一电离能比E小;G的+1价离子(G+)的各层电子全充满。回答下列问题: (相关问题用元素符号表示)
(1)写出E的基态原子的电子排布式________________________。
(2)B与C可形成化合物BC和BC2,BC2属于__________(填“极性”、“非极性”)分子,1 mol BC含有π键为____________________mol。
(3)由元素A、C、G组成的离子[G(A2C)4]2+在水溶液中显天蓝色,不考虑空间结构,[G(A2C)4]2+的结构可用示意图表示为__________(配位键用→标出)。
(4)测定A、D形成的化合物的相对分子质量时,实验测定值一般高于理论值的原因是_______。
(5)由元素A、B、F组成的原子个数比9 : 3 : 1的一种物质,分子中含三个相同的原子团,其结构简式为________________,分子中F原子的杂化方式为__________,该物质遇水爆炸,生成白色沉淀和无色气体,反应的化学方程式为____________________。
(6)G与氮元素形成的某种化合物的晶胞结构如图,则该化合物的化学式为__________,若晶体密度为a g·cm-3,列式计算G原子与氮原子最近的距离为__________pm(不必计算出数值,阿伏加德罗常数的值用NA表示)。

【答案】1s22s22p63s2 非极性 2 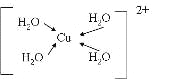 HF分子之间存在氢键,形成缔合分子 Al(CH3)3 sp2杂化 Al(CH3)3+3H2O = Al(OH)3↓+3CH4↑ Cu3N
HF分子之间存在氢键,形成缔合分子 Al(CH3)3 sp2杂化 Al(CH3)3+3H2O = Al(OH)3↓+3CH4↑ Cu3N 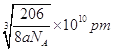
【解析】
在前四周期中原子序数依次增大的七种元素A、B、C、D、E、F、G中,A的原子核外电子只有一种运动状态,故A为H;B、C的价电子层中未成对电子数都是2,则B、C核外电子排布为1s22s22p2或1s22s22p4,为C、O;B、C、D同周期且原子序数依次增大,故D为F;E核外的s、p能级的电子总数相等,故E为Mg,F与E同周期且第一电离能比E小,F为Na,G的+1价离子(G+)的各层电子全充满,元素的基态原子最外能层只有一个电子,其它能层均已充满电子,则核外电子数为2+8+18+1=29,故G为Cu。
(1)E为Mg元素,基态原子的电子排布为1s22s22p63s2;
(2)B(C)与C(O)可形成化合物BC(CO)和BC2(CO2),CO2结构式为O=C=O,电荷中心重合,为非极性分子,CO的结构式为C≡O,含有2molπ键;
(3)Cu(H2O)42+,水与铜离子形成4个配位键,结构为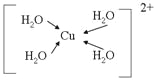 ;
;
(4)测定A、D形成的化合物HF的相对分子质量时,实验测定值一般高于理论值的原因是HF分子之间存在氢键,形成缔合分子;
(5)由元素H、C、Al组成的原子个数比9:3:1的一种物质,分子中含三个相同的原子团,其结构简式为Al(CH3)3,根据价层电子对互斥理论计算电子对数为3+(3-3×1)/2=3,杂化类型为sp2,该物质遇水爆炸,生成白色沉淀和无色气体,反应的化学方程式为Al(CH3)3+3H2O=Al(OH)3↓+3CH4↑;
(6)晶胞中Cu原子数目=12×1/4=3、N原子数目=8×1/8=1,故化学式为:Cu3N;晶胞的质量=(64×3+14)÷NAg,紧邻的白球与黑球之间的距离为bcm,则晶胞棱长=2bcm,则晶胞体积=(2bcm)3,故晶体的密度=[(64×3+14)÷NA]÷(2bcm)3=agcm-3,b=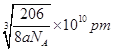 。
。
【点晴】
该题难度较大,元素推断是解题的关键,需要学生具备扎实的基础,(6)中注意利用均摊法计算晶胞质量是解答的难点和易错点。晶胞中原子的数目往往采用均摊法,具体方法为:①位于晶胞顶点的原子为8个晶胞共用,对一个晶胞的贡献为1/8;②位于晶胞面心的原子为2个晶胞共用,对一个晶胞的贡献为1/2;③位于晶胞棱心的原子为4个晶胞共用,对一个晶胞的贡献为1/4;④位于晶胞体心的原子为1个晶胞共用,对一个晶胞的贡献为1。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氧化还原滴定原理同中和滴定原理相似,为了测定某未知浓度的NaHSO3溶液的浓度,现用0.2000mol/L的酸性KMnO4溶液进行滴定,回答下列问题:
(1) 配平离子方程式:______MnO4-+HSO3-+H+=Mn2++SO42-+H2O。
(2)用KMnO4进行滴定时,KMnO4溶液应装在_______________中,判断滴定终点的现象是_______。
(3)下列操作会导致测定结果偏高的是_________。
A. 盛装未知浓液的锥形瓶用蒸馏水洗过,未用待测液润洗
B. 未用标准浓度的酸性KMnO4溶液润洗滴定管
C. 观察读数时,滴定前仰视,滴定后俯视
D. 滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
(4) 根据下表测定的实验数据,计算KMnO4溶液体积的平均值为___mL;NaHSO3溶液的物质的量浓度为___mol/L(数据精确到0.1)。
试验编号 | 待测NaHSO3溶液的体积/ mL | KMnO4溶液体积/ mL |
1 | 20.00 | 15.98 |
2 | 20.00 | 17.00 |
3 | 20.00 | 16.02 |