题目内容
19.下列说法中不正确的是( )| A. | 在标准状况下,氯气的密度约为3.17g/L | |
| B. | 密闭容器中的氯水放置数天后,pH变小且几乎失去漂白性 | |
| C. | 液氯具有漂白性,干燥的氯气和液氯均能使干燥的有色布条褪色 | |
| D. | 在通常情况下,氯气可以和某些金属直接化合 |
分析 A.依据ρ标=$\frac{M}{Vm}$计算;
B.次氯酸见光分解生成氯化氢和氧气;
C.氯气不具有漂白性,据有漂白性的是次氯酸;
D.氯气具有强的氧化性.
解答 解:A.标况下氯气的密度ρ标=$\frac{M}{Vm}$=$\frac{71g}{22.7L}$=3.17g/L,故A正确;
B.氯水中具有漂白性的是次氯酸,次氯酸见光分解生成氯化氢和氧气,所以放置数天后,pH变小且几乎失去漂白性,故B正确;
C.液氯为氯气的液态形式,不具有漂白性,干燥的氯气和液氯均不能使干燥的有色布条褪色,故C错误;
D.氯气具有强的氧化性,在通常情况下,氯气可以和某些金属直接化合,故D正确;
故选:C.
点评 本题考查了元素化合物知识,侧重考查氯气的性质,解题时注意氯气、次氯酸性质的区别,题目难度不大.

练习册系列答案
相关题目
9.苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理:
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.
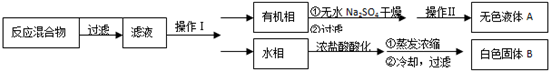
已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是紫色溶液褪色.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
(4)纯度测定:称取1.220g产品,配成100ml甲醇溶液,移取25.00ml溶液,滴定,消耗KOH的物质的量为2.40×10-3mol,产品中苯甲酸质量分数的计算表达式为$\frac{2.4×10{\;}^{-3}mol×4×122g/mol}{1.22g}$×100%,计算结果为96%(保留二位有效数字).

实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.

已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物都有固定熔点.
(1)操作Ⅰ为分液,操作Ⅱ为蒸馏.
(2)无色液体A是甲苯,定性检验A的试剂是酸性KMnO4溶液,现象是紫色溶液褪色.
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶解, 冷却、过滤 | 得到白色晶体和无色溶液 | |
| ② | 取少量滤液于试管中,滴入适量的硝酸酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,加热使其熔化,测其熔点 | 熔点为122.4℃ | 白色晶体是苯甲酸 |
7.胶体区别于其它分散系最本质的特征是( )
| A. | 外观澄清、透明 | B. | 胶体粒子直径在1~100nm之间 | ||
| C. | 能产生丁达尔现象 | D. | 外观澄清、不透明 |
14.下列关于氯气的叙述中不正确的是( )
| A. | 可用向上排空气法收集少量的氯气 | |
| B. | 与水反应生成的次氯酸是一种弱酸 | |
| C. | 与石灰乳反应时,Cl2既被还原,同时又被氧化 | |
| D. | 常温下干燥的Cl2能用钢瓶贮运,所以Cl2与铁不能发生化学反应 |
4.下列物质中属于电解质的是( )
| A. | C12H22O11(蔗糖) | B. | CO2 | C. | NaCl | D. | Al |
11.下列有关氮元素及其化合物的表示正确的是( )
| A. | 质子数为7、中子数为8的氮原子:${\;}_{7}^{8}$N | |
| B. | 氮离子(N3-)的结构示意图: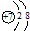 | |
| C. | 氨分子的电子式: | |
| D. | 硝基苯的结构简式: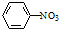 |
9.下列除杂的方法正确的是( )
| A. | 除去N2中的少量O2:通过灼热的CuO粉末,收集气体 | |
| B. | 除去CO2中的少量HCl:通入过量NaOH溶液,收集气体 | |
| C. | 除去KCl溶液中少量MgCl2:加入适量NaOH溶液,过滤 | |
| D. | 除去NaCl溶液中少量CaCl2:加入过量Na2CO3溶液,过滤,滤液中再加入过量盐酸,加热 |
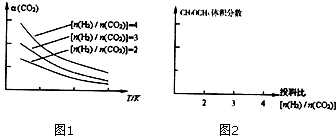 将燃煤废气中的CO2转化为二甲醚的反应原理为:
将燃煤废气中的CO2转化为二甲醚的反应原理为: 电解饱和食盐水所得溶液经多次循环使用后,ClO-、ClO${\;}_{3}^{-}$含量会增加.
电解饱和食盐水所得溶液经多次循环使用后,ClO-、ClO${\;}_{3}^{-}$含量会增加.