题目内容
许多金属及它们的化合物在科学研究和工业生产中具有许多用途。
回答下列有关问题:
(1)基态Ni的核外电子排布式为__________________________________________,
第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是________。
(2)配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=________,CO与N2结构相似,CO分子内σ键与π键个数之比为________。
(3)NiO、FeO的晶体结构类型均与氯化钠的相同。
①Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO________FeO(填“<”或“>”);
②NiO晶体中Ni的配位数为________。
(4)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是________________________________________________________________________________________________________________________________________________,
反应的离子方程式为________________________________________________________________________。
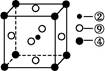
(5)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为________,若该晶胞的边长为a pm,则合金的密度为________g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
回答下列有关问题:
(1)基态Ni的核外电子排布式为__________________________________________,
第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是________。
(2)配合物Ni(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=________,CO与N2结构相似,CO分子内σ键与π键个数之比为________。
(3)NiO、FeO的晶体结构类型均与氯化钠的相同。
①Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO________FeO(填“<”或“>”);
②NiO晶体中Ni的配位数为________。
(4)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是________________________________________________________________________________________________________________________________________________,
反应的离子方程式为________________________________________________________________________。
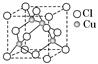
(5)一种铜金合金晶体具有面心立方最密堆积的结构。在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为________,若该晶胞的边长为a pm,则合金的密度为________g·cm-3(只要求列算式,不必计算出数值,阿伏加德罗常数为NA)。
(1)1s22s22p63s23p63d84s2 C(碳)
(2)4 1∶2
(3)①> ②6
(4)H2O2为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行 Cu+H2O2+4NH3=Cu(NH3)42++2OH-
(5)1∶3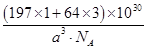
(2)4 1∶2
(3)①> ②6
(4)H2O2为氧化剂,氨与Cu2+形成配离子,两者相互促进使反应进行 Cu+H2O2+4NH3=Cu(NH3)42++2OH-
(5)1∶3
(1)Ni基态原子中未成对电子数为2,与之未成对电子数相同的第二周期元素为碳元素和氧元素,电负性最小的为碳元素。(2)Ni原子价电子数为10,配体CO可以提供一个孤电子对,则n=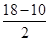 =4;氮氮三键中含有1个σ 键和2个π键,CO与N2结构相似,故CO分子内σ键与π键个数之比为1∶2。(3)①离子晶体中,在其他因素一样时,离子半径越小,离子键就越强,熔点越高;②NiO的晶体结构类型与氯化钠的相同,均为立方最密堆积,Ni原子与O原子的配位数均为6。(4)H2O2具有强氧化性,可以将Cu氧化为Cu2+,但反应速率很小,而氨与Cu2+形成配离子,两个反应相互促进使反应速率加快,反应得以进行。(5)Au原子位于顶点,则一个晶胞中含有Au原子数为8×
=4;氮氮三键中含有1个σ 键和2个π键,CO与N2结构相似,故CO分子内σ键与π键个数之比为1∶2。(3)①离子晶体中,在其他因素一样时,离子半径越小,离子键就越强,熔点越高;②NiO的晶体结构类型与氯化钠的相同,均为立方最密堆积,Ni原子与O原子的配位数均为6。(4)H2O2具有强氧化性,可以将Cu氧化为Cu2+,但反应速率很小,而氨与Cu2+形成配离子,两个反应相互促进使反应速率加快,反应得以进行。(5)Au原子位于顶点,则一个晶胞中含有Au原子数为8×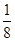 =1,Cu原子位于面心,则一个晶胞中含有Cu原子数为6×
=1,Cu原子位于面心,则一个晶胞中含有Cu原子数为6×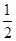 =3,故该合金中Au原子与Cu原子个数之比为1∶3;一个晶胞的质量为
=3,故该合金中Au原子与Cu原子个数之比为1∶3;一个晶胞的质量为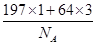 g,一个晶胞的体积为a3 pm3,故合金的密度为
g,一个晶胞的体积为a3 pm3,故合金的密度为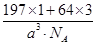 g·pm-3=
g·pm-3=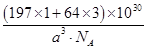 g·cm-3。
g·cm-3。
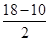 =4;氮氮三键中含有1个σ 键和2个π键,CO与N2结构相似,故CO分子内σ键与π键个数之比为1∶2。(3)①离子晶体中,在其他因素一样时,离子半径越小,离子键就越强,熔点越高;②NiO的晶体结构类型与氯化钠的相同,均为立方最密堆积,Ni原子与O原子的配位数均为6。(4)H2O2具有强氧化性,可以将Cu氧化为Cu2+,但反应速率很小,而氨与Cu2+形成配离子,两个反应相互促进使反应速率加快,反应得以进行。(5)Au原子位于顶点,则一个晶胞中含有Au原子数为8×
=4;氮氮三键中含有1个σ 键和2个π键,CO与N2结构相似,故CO分子内σ键与π键个数之比为1∶2。(3)①离子晶体中,在其他因素一样时,离子半径越小,离子键就越强,熔点越高;②NiO的晶体结构类型与氯化钠的相同,均为立方最密堆积,Ni原子与O原子的配位数均为6。(4)H2O2具有强氧化性,可以将Cu氧化为Cu2+,但反应速率很小,而氨与Cu2+形成配离子,两个反应相互促进使反应速率加快,反应得以进行。(5)Au原子位于顶点,则一个晶胞中含有Au原子数为8×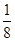 =1,Cu原子位于面心,则一个晶胞中含有Cu原子数为6×
=1,Cu原子位于面心,则一个晶胞中含有Cu原子数为6×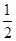 =3,故该合金中Au原子与Cu原子个数之比为1∶3;一个晶胞的质量为
=3,故该合金中Au原子与Cu原子个数之比为1∶3;一个晶胞的质量为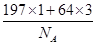 g,一个晶胞的体积为a3 pm3,故合金的密度为
g,一个晶胞的体积为a3 pm3,故合金的密度为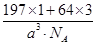 g·pm-3=
g·pm-3=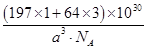 g·cm-3。
g·cm-3。
练习册系列答案
相关题目

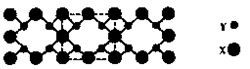


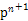 ,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 。
,该元素原子的核外最外层电子的孤电子对数为 ;该元素与元素①形成的分子X构形为 ;X在①与③形成的分子Y中的溶解度很大,其主要原因是 。