��Ŀ����
����Ŀ���ں�����������ʼʱ�ݻ���Ϊ5L�ļס������ܱ�������(��Ϊ������������Ϊ��ѹ����)�������з�Ӧ��N2(g)+3H2(g)![]() 2NH3(g) ��H2=-92.4kJ/mol ���й����ݼ��ض�ƽ��״̬���±���
2NH3(g) ��H2=-92.4kJ/mol ���й����ݼ��ض�ƽ��״̬���±���
���� | ��ʼͶ�� | ��ƽ��ʱ | ||
�� | 2molN2 | 3molH2 | 0molNH3 | 1.5molNH3 |
�� | amolN2 | bmolH2 | 0molNH3 | 1.2molNH3 |
(1)��ƽ���ͬ�����ʵ����������ͬ����ʼʱ������ͨ���N2�����ʵ���Ϊ ����ʼʱ���е�ѹǿ�Ǽ������� �����ҵ�ƽ�ⳣ��Ϊ
(2)�����ܱ������п��Է��������ķֽⷴӦ����ƽ����ı��±��з�Ӧ����x�����и�����y��x�������������� (ѡ�����)��
a | b | c | d | |
x | �¶� | �¶� | ����H2�����ʵ��� | ���백�������ʵ��� |
y | ��������ƽ����Է������� | ƽ�ⳣ��K | ���������ܶ� | ��ƽ��ʱ������ת���� |
(3)�о���������������ʱ���ı���ʼ�����������ʵ����Է�Ӧ��Ӱ�죬ʵ������ͼ��ʾ(ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ���)��
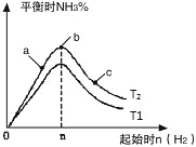
����T2��T1�Ĺ�ϵ�ǣ�T2 T1(����ڡ������ڡ������ڡ�����ȷ����)��
��a��b��c�����У�N2ת������ߵ��� (����ĸ)��
���������ݻ�Ϊ1L��T2������ʼ��ϵ�м���1molN2��3molH2������5min��Ӧ�ﵽƽ��ʱH2��ת����Ϊ60%����NH3�ķ�Ӧ����Ϊ ����������������䣬����ʼʱ�������ڷ���2molN2��6molH2����ƽ���ų�������ΪQ����Q_________110.88kJ(�>������<����=��)��
���𰸡�(1)1.6mol 0.8 107(mol/L)-2 (2) bc
(3) < b 0.24mol.L-1.min-1 >
��������
���������(1)�ס�������ʵ����ͬ�����ʵ����������ͬ��˵���ﵽ��ͬ��ƽ��״̬�����������V��![]() ��V=4L����������ʽ��
��V=4L����������ʽ��
�ף� N2+3H2![]() 2NH3��
2NH3��
��ʼ�� 2 3 0
�仯�� 0.75 2.25 1.5
ƽ���� 1.25 0.75 1.5
�ң� N2+3H2![]() 2NH3��
2NH3��
��ʼ�� a b 0
�仯�� 0.6 1.8 1.2
ƽ���� a-0.6 b-1.8 1.2
![]() ����a=1.6mol��
����a=1.6mol��![]() ����b=2.4mol��
����b=2.4mol��
��ʼʱ�������е�ѹǿ�Ǽ������ı���Ϊ��![]() ��
��
�ҵ�ƽ�ⳣ��k=![]() =107(mol/L)-2��
=107(mol/L)-2��
(2)a���÷�Ӧ�����ȷ�Ӧ�������¶�ƽ��������Ӧ�����ƶ���������������ʵ���������������������䣬ƽ����Է���������С����a����b��ƽ�ⳣ��ֻ���¶��йأ��¶ȸı�ƽ�ⳣ���ı䣬�����¶�ƽ��������Ӧ�����ƶ���ƽ�ⳣ������b��ȷ��c�������������������������������������䣬��������ܶ�����c��ȷ��d�����백����ƽ��������Ӧ�����ƶ�������ת���ʼ�С����d�����ʴ�Ϊbc��
(3)��Ϊ��ӦΪ���ȷ�Ӧ���¶�����ѧƽ���������ȷ�����У���T1��T2�����ﰱ���������ӣ�ƽ�����ƣ���T2��T1��
��b�����ƽ��״̬��c���ּ�������������ƽ�������ƶ���������ת��������
����ѧƽ������ʽ������ʽ���㣬
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
��ʼ��(mol)1 3 0
�仯��(mol)0.6 3��60% 1.2
ƽ����(mol)0.4 1.2 1.2
��Ӧ����v=![]() =0.24mol��L-1��min-1����ʱ��Ӧ�ų�����=92.4kJ/mol��1.8/3=55.44KJ�����ƽ�����H2��ת����Ϊ60%ʱ�ų�������������ʼʱ�������ڷ���2mol N2��6mol H2���൱������ѹǿƽ��������У���Ӧ�ǿ��淴Ӧ���ܽ��г��ף��ų�����С��2��92.4kJ/mol=184.8KJ������H2��ת����Ϊ60%ʱ�ų���������2������������55.44KJ��2=110.88kJ��
=0.24mol��L-1��min-1����ʱ��Ӧ�ų�����=92.4kJ/mol��1.8/3=55.44KJ�����ƽ�����H2��ת����Ϊ60%ʱ�ų�������������ʼʱ�������ڷ���2mol N2��6mol H2���൱������ѹǿƽ��������У���Ӧ�ǿ��淴Ӧ���ܽ��г��ף��ų�����С��2��92.4kJ/mol=184.8KJ������H2��ת����Ϊ60%ʱ�ų���������2������������55.44KJ��2=110.88kJ��


