��Ŀ����
����Ŀ����仯ѧ���������о����̿�(��Ҫ�ɷ���MnO2)�Ĺ����У�������Ũ�����ϼ��ȣ������˻���ɫ���塣
(1)�÷�Ӧ�Ļ�ѧ����ʽΪ____________________��
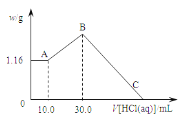
(2)��Ӧ����������_______���ѧʽ������Ԫ�صĻ��ϼ�________����������������������������������17.4 g MnO2�������ɱ�״����Cl2�������_______L��ת�Ƶ��ӵ����ʵ�����______mol��
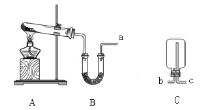
(3)�ô˷�Ӧ�Ƶõ������г�����_______��Ҫ�ռ������﴿����������Ӧʹ��������ͨ��װ��_______��_______��ϴ��ƿ�����ռ���
���𰸡�MnO2+4HCl(Ũ)![]() MnCl2+Cl2��+2H2O MnO2 ���� 4.48 0.4 HCl��ˮ���� �����Ȼ�����Һ Ũ����
MnCl2+Cl2��+2H2O MnO2 ���� 4.48 0.4 HCl��ˮ���� �����Ȼ�����Һ Ũ����
��������
(1)MnO2��Ũ�����ϼ��ȣ�����������ԭ��Ӧ����������
(2)�ڷ�Ӧ�У�Ԫ�ػ��ϼ����ߣ�ʧȥ���ӣ���������ԭ����Ԫ�ػ��ϼ۽��ͣ��õ����ӣ������������������ݷ���ʽ������ת����ϵ������MnO2���������㷴Ӧ������Cl2�����ʵ�����������V=n��Vm���������ڱ�״���µ����������Ԫ�ػ��ϼ������������ڷ�Ӧ�����е���ת�������������ת�Ƶ����ʵ�����
(3)����������лӷ��ԣ���Ϸ�Ӧ��Ҫ�ڼ��������·��������л��е����ʣ����ӵ�˳�����ȳ�ȥ�������ʣ������
(1)MnO2��Ũ�����ϼ��ȣ������˻���ɫCl2����Ӧ�ķ���ʽΪ��MnO2+4HCl(Ũ)![]() MnCl2+Cl2��+2H2O��
MnCl2+Cl2��+2H2O��
(2)�ڸ÷�Ӧ�У�MnԪ�ػ��ϼ��ɷ�ӦǰMnO2�е�+4�۱�Ϊ��Ӧ��MnCl2�е�+2�ۣ����ϼ۽��ͣ��õ����ӣ�����MnO2����������17.4 g MnO2�����ʵ���Ϊn(MnCl2)=17.4 g��87 g/mol= 0.2 mol�����ݷ���ʽMnO2+4HCl(Ũ)![]() MnCl2+Cl2��+2H2O��֪��ÿ��1 mol MnO2��Ӧ�������1 mol Cl2����0.2 mol MnO2��Ӧ����Cl2�����ʵ�����0.2 mol���ڱ�״���µ����V=n��Vm=0.2 mol��22.4 L/mol=4.48 L���ɷ���ʽ��֪��1 mol MnO2��Ӧ��ת��2 mol ���ӣ���0.2 mol MnO2��Ӧ��ת��0.4 mol ���ӣ�
MnCl2+Cl2��+2H2O��֪��ÿ��1 mol MnO2��Ӧ�������1 mol Cl2����0.2 mol MnO2��Ӧ����Cl2�����ʵ�����0.2 mol���ڱ�״���µ����V=n��Vm=0.2 mol��22.4 L/mol=4.48 L���ɷ���ʽ��֪��1 mol MnO2��Ӧ��ת��2 mol ���ӣ���0.2 mol MnO2��Ӧ��ת��0.4 mol ���ӣ�
(3)��Ũ������������̻�ϼ�����ȡ������Ũ������лӷ��ԣ���Ӧ����Һ�н��У������ȡ�õ��������к�������HCl��ˮ������Ҫ�ռ������﴿����������Ӧʹ������ͨ��װ�б����Ȼ���ˮ��ϴ��ƿ��ȥ����HCl��Ȼ����ͨ��Ũ������и������ٽ����ռ���

 ����5��2���ϵ�д�
����5��2���ϵ�д�