题目内容
Cu2S与一定浓度的HNO3反应,生成Cu(NO3)2、CuSO4、NO2、NO和H2O,当NO2和NO的物质的量之比为1∶1时,实际参加反应的Cu2S与HNO3的物质的量之比为( )。A.1∶7 B.1∶9 C.1∶5 D.2∶9
A
【试题分析】
Cu2S中+1价的Cu被氧化为+2价,-2价的S被氧化为+6价,因此1molCu2S被HNO3完全氧化失去10mol电子,根据氧化还原反应中得失电子总数相等可知,生成NO2和NO的总物质的量为5mol,根据溶液中电荷守恒可得:2n(Cu2+)=n(
 )+2n(SO42-),代入相关数据得n(
)+2n(SO42-),代入相关数据得n(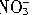 )=2mol,所以实际参加反应的HNO3的物质的量为7mol(此处利用了N原子守恒)。
)=2mol,所以实际参加反应的HNO3的物质的量为7mol(此处利用了N原子守恒)。 
练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目