题目内容
下列三个化学反应的平衡常数(K1、K2、K3)与温度的关系分别如下表所示:
化学反应 | 平衡常数 | 温度 | |
973K | 1173K | ||
①Fe(s)+CO2(g) | K1 | 1.47 | 2.15 |
②Fe(s)+H2O(g) | K2 | 2.38 | 1.67 |
③CO(g)+H2O(g) | K3 | ? | ? |
则下列说法正确的是
A.△H1<0,△H2>0
B.反应①②③的反应热满足关系:△H2-△H1=△H3
C.反应①②③的平衡常数满足关系:K1·K2=K3
D.要使反应③在一定条件下建立的平衡向正反应方向移动,可采取升温措施
 名师点拨卷系列答案
名师点拨卷系列答案酸性KMnO4溶液与H2C2O4溶液的反应通常用来研究浓度对反应速率的影 响。现有甲、乙两个实验小组设计不同的实验方案如下:
响。现有甲、乙两个实验小组设计不同的实验方案如下:
甲组:改变反应物的浓度,通过溶液褪色的时间来比较反应速率快慢。
可以使用的试剂有:① 0.01mol/L KMnO4酸性溶液、② 0.02mol/L KMnO4酸性溶液、③ 0.1 mol/L H2C2O4溶液、④ 0.2 mol/L H2C2O4溶液。
(1)酸性KMnO4溶液与H2C2O4溶液反应的离子方程式为:__________________________;
(2)请从上面的四种溶液中选择本实验所需的三种溶液(填写序号)_______________;
(3)问题讨论:已知该实验过程中溶液温度几乎不变,但是依据实验数据发现开始一段时间后速率却在增大。
①你认为引起该反应速率增大的因素是_____________________。
②欲设计实验确认,请完成以下设计表a、b、c(褪色时间不需填写):
实验 编号 | 0.01mol/LKMnO4酸性溶液/mL | 0.2mol/L H2C2O4溶液/mL | MnSO4 固体/g | 褪色 时间/s |
1 |
| 2 mL | a | |
2 | b | c | 0.2 g |
乙组:通过测定不同浓度的溶液生成CO2气体体积的方法来比较化学反应速率的大小。
实验装置如图,实验时分液漏斗中A溶液一次性放入B溶液中
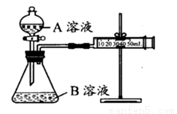
已知乙组完成两次实验分别是Ⅰ、Ⅱ。请完成以下各空:
(4)如何检查该装置的气密性:___________________。
(5)分析所给实验仪器,实现该实验目的还欠缺的仪器:_________________。你将如何比较Ⅰ、Ⅱ化学反应速率 大小?你的操作是_________________________。
大小?你的操作是_________________________。
 FeO(s)+CO(g) △H1
FeO(s)+CO(g) △H1

 2C(g)△H>0。下列反应有利于生成C的是
2C(g)△H>0。下列反应有利于生成C的是 CO(NH2)2(s)+H2O(g) 在合成塔中进行。下图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
CO(NH2)2(s)+H2O(g) 在合成塔中进行。下图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
 CH3OH(g) 达到平衡。下列说法正确的是
CH3OH(g) 达到平衡。下列说法正确的是
 ×100%
×100%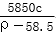 g
g cm3、质量分数为98%的浓硫酸稀释成1 000 mL、物质的量浓度为2 mol/L的稀硫酸。求:
cm3、质量分数为98%的浓硫酸稀释成1 000 mL、物质的量浓度为2 mol/L的稀硫酸。求: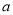 mol Na+,则锥形瓶容积为
mol Na+,则锥形瓶容积为
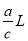 B.
B.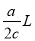 C.
C.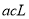 D.
D.