题目内容
【题目】铁和碘、氮的相关化合物在化工、材料等领域有着广泛的应用。回答下列问题:
(1)基态Fe原子中,核外未成对电子数为________个,铁的第三电离能I3(Fe)比锰的第三电高能I3(Mn)小其原因是__________________________________________________。
(2)NaNO2可用作肉类食品的发色剂,阴离子NO2-的几何构型为_________,中心原子的杂化轨道类型为_________。
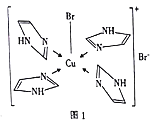
(3)Cu2+的一种配合物的分子结构如图1所示,配位原子为________,配体![]() 分子中σ键总数为________个,分子中的大π键可用符号
分子中σ键总数为________个,分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则
),则![]() 中的大π键应表示为________________。
中的大π键应表示为________________。

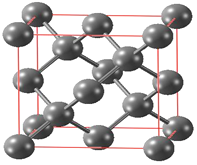
(4)一种铁的氧化物由不同价态的铁原子[Fe(A)和Fe(B)]与氧原子构成,其晶胞内部有图示Ⅰ、Ⅱ两种结构,晶胞的部分结构如图2。
①该铁的氧化物的化学式为_________,其熔点为1594.5 ℃,则它属于_________ (填“原子”“离子”或“分子”)晶体。
②该晶胞边长为a pm,则其密度为____________________g·cm-3(列出表达式即可)。
【答案】 4 锰失去的是较稳定的半充满3d5上的一个电子,铁失去的是3d6上的一个电子变为半充满状态 V形 sp2 N和Br 9 ![]() Fe3O4 离子
Fe3O4 离子 ![]() (或
(或![]() ×102)
×102)
【解析】(1) Fe原子核外有26个电子,基态Fe原子的核外电子排布式为:1s22s22p63s23p63d64s2,未成对电子数为4个;由Mn2+转化为Mn3+时,3d能级由较稳定的3d5半充满状态转为不稳定的3d4状态;而Fe2+到Fe3+时,3d能级由不稳定的3d6到稳定的3d5半充满状态,故铁的第三电离能I3(Fe)比锰的第三电高能I3(Mn)小;(2) NO2-的中心原子N原子的价电子对数=![]() =3,所以N是sp2杂化,价电子构型为平面三角型,由于氮只和两个氧连接,所以一个杂化轨道由一个孤电子对占据,分子构型为v型;中心原子的杂化轨道类型为sp2;(3)根据图1可知,Cu2+的配位原子为N和Br,配体
=3,所以N是sp2杂化,价电子构型为平面三角型,由于氮只和两个氧连接,所以一个杂化轨道由一个孤电子对占据,分子构型为v型;中心原子的杂化轨道类型为sp2;(3)根据图1可知,Cu2+的配位原子为N和Br,配体![]() 分子中有1个碳碳σ键、4个碳氮σ键、3个碳氢σ键、1个氮氢σ键总数为9个σ键;
分子中有1个碳碳σ键、4个碳氮σ键、3个碳氢σ键、1个氮氢σ键总数为9个σ键;![]() 分子中参与形成大π键的原子数为5,参与形成大π键的电子数为6,则
分子中参与形成大π键的原子数为5,参与形成大π键的电子数为6,则![]() 中的大π键应表示为
中的大π键应表示为![]() ;(4)①根据均摊法,由图示知,Ⅰ、Ⅱ两种结构氧原子总数为
;(4)①根据均摊法,由图示知,Ⅰ、Ⅱ两种结构氧原子总数为![]() ,铁原子数目为Fe(A)6、Fe(B)2+
,铁原子数目为Fe(A)6、Fe(B)2+![]() ,总数为12,最简比为3:4,该铁的氧化物的化学式为Fe3O4,其熔点为1594.5℃,则它属于离子晶体;②该晶胞边长为apm,体积为
,总数为12,最简比为3:4,该铁的氧化物的化学式为Fe3O4,其熔点为1594.5℃,则它属于离子晶体;②该晶胞边长为apm,体积为![]() ,则其密度为
,则其密度为![]() g·cm-3。
g·cm-3。

 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案 一线名师权威作业本系列答案
一线名师权威作业本系列答案【题目】卤族元素的单质能与H2反应,反应情况如下表所示:
F2 | 在暗处能剧烈化合并发生爆炸,生成的氟化氢很稳定 |
Cl2 | 光照或点燃发生反应,生成的氯化氢较稳定 |
Br2 | 加热至一定温度才能反应,生成的溴化氢不如氯化氢稳定 |
I2 | 不断加热才能缓慢反应,同一条件下,生成的HI会分解 |
(1)卤族元素位于周期表中的_________族。
(2)用电子式表示HCl的形成过程________。
(3)依据上表,可以推测出:随着核电荷数的增加,________(填字母)。
a. 单质的熔沸点逐渐升高 b. 元素的非金属性逐渐减弱
c. 卤化氢的还原性依次减弱 d. 卤化氢的稳定性依次减弱
(4)I2与H2反应的化学方程式是________。
(5)不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近。BrCl和FeCl2水溶液发生反应的化学方程式为________。