题目内容
| A.CH4>GeH4>SnH4 | B.KCl>NaCl>MgCl2>MgO |
| C.Rb>K>Na>Li | D.石墨>金刚石>SiO2>MgO |
D
晶体熔点的高低取决于构成该晶体结构的粒子间结合能力的大小。
A项物质均为结构相似的分子晶体,其熔点取决于分子间作用力的大小。一般来说,结构相似的分子晶体,相对分子质量越大,分子间作用力也越大,故A项各物质熔点应为逐渐升高的顺序。
B项物质均为离子晶体,离子晶体熔点高低取决于离子键键能的大小,离子的半径越小,电荷越多,离子键的键能就越大,故B项各物质熔点也应为升高顺序。
C项物质均为同主族的金属晶体,其熔点高低取决于金属键的强弱,而金属键能与金属原子半径成反比,与价电子数成正比;碱金属原子半径依Li一Cs的顺序增大,价电子数相同,故熔点应是Li最高,Cs最低。
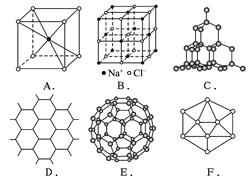
D:一般原子晶体的熔点高于离子晶体。原子晶体的熔点取决于共价键的键能,而键能则与键长成反比,即:键长越短则键能越大;石墨中C—C键的键长比金刚石中C—C键的键长更短些,所以石墨熔点比金刚石略高,金刚石熔点又比二氧化硅高。
A项物质均为结构相似的分子晶体,其熔点取决于分子间作用力的大小。一般来说,结构相似的分子晶体,相对分子质量越大,分子间作用力也越大,故A项各物质熔点应为逐渐升高的顺序。
B项物质均为离子晶体,离子晶体熔点高低取决于离子键键能的大小,离子的半径越小,电荷越多,离子键的键能就越大,故B项各物质熔点也应为升高顺序。
C项物质均为同主族的金属晶体,其熔点高低取决于金属键的强弱,而金属键能与金属原子半径成反比,与价电子数成正比;碱金属原子半径依Li一Cs的顺序增大,价电子数相同,故熔点应是Li最高,Cs最低。
D:一般原子晶体的熔点高于离子晶体。原子晶体的熔点取决于共价键的键能,而键能则与键长成反比,即:键长越短则键能越大;石墨中C—C键的键长比金刚石中C—C键的键长更短些,所以石墨熔点比金刚石略高,金刚石熔点又比二氧化硅高。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目