题目内容
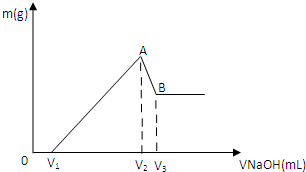
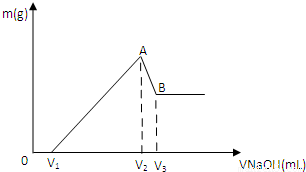
将0.1molMg、Al混合物溶于100mL4mol/L的盐酸中,然后再滴加1mol/L的NaOH溶液,在滴加NaOH溶液的过程中,沉淀质量m与NaOH溶液的体积V的变化如图所示。
(1)写出BC过程的离子反应方程式
(2)当V1=140mL时,混合物中n(Mg)=_____mol,V2=_____mL
(3)滴入的NaOH溶液_____mL时,溶液中的Mg2+和Al3+刚好沉淀完全。
(4)若混合物中Mg的物质的量分数为a,当滴入的NaOH溶液为450mL时,所得沉淀中无Al(OH)3,则a的取值范围是____________________
(5)当加入V2 mlNaOH溶液后过滤,向滤液中通入过量的CO2气体,能观察到的现象为 ,写出该过程反应的离子方程式 。
(1)Al(OH)3 + OH- ==AlO2- +2H2O (2) 0.04 460 (3) 400 (4)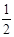 ≤a<1
≤a<1
(5)白色胶状沉淀 AlO2- + CO2 + 2H2O ==Al(OH)3↓+HCO3-
解析试题分析:(1)由图可以知道,刚开始为酸碱中和,从V1开始,边有沉淀生成,而由于氢氧化铝为两性物质,故BC过程的离子反应方程式为:Al(OH)3 + OH- ==AlO2- +2H2O;(2)当V1=140mL时,则与镁铝反应的盐酸的量n=0.1×4-0.14×1=0.26mol,设镁为amol,铝为bmol,即a+b=0.1,2a+3b=0.26,联立解得a=0.04,b=0.06,所以混合物中n(Mg)=0.04mol,即从V1到V2所需要的氢氧化钠的物质的量n=0.04×2+0.06×4=0.32,故需要氢氧化钠的体积为0.32/1=0.32L=320mL,所以V2=140+320=460mL;溶液中的Mg2+和Al3+刚好沉淀完全,为图中的b点,故需要氢氧化钠的量n=0.04×2+0.06×3=0.26,故需要氢氧化钠的体积为0.26/1=0.26L=260mL,所以V2=140+260=400mL,故滴入的NaOH溶液为100mL时,溶液中的Mg2+和Al3+刚好沉淀完全;(4)0.1molMg、Al混合物溶于100mL4mol/L的盐酸中,100mL4mol/L的盐酸中氢离子的物质的量为0.4mol,而Mg、Al转化为离子,而450mLNaOH溶液中氢氧根的物质的量为0.45mol,故只能有0.45-0.4=0.05mol的氢氧根来溶解氢氧化铝,根据
Al(OH)3 + OH- ==AlO2- +2H2O可以知道,Al(OH)3的物质的量不能超过0.05mol,所以即a要大于等于0.05/0.1=0.5,而有不能大于0.1/0.1=1,即a的取值范围为: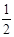 ≤a<1;(5) 当加入V2 mlNaOH溶液后过滤,向滤液中通入过量的CO2气体,则产生了氢氧化铝沉淀,故能观察到的现象为产生了白色胶状沉淀,该离子方程式为:AlO2- + CO2 + 2H2O ==Al(OH)3↓+HCO3-。
≤a<1;(5) 当加入V2 mlNaOH溶液后过滤,向滤液中通入过量的CO2气体,则产生了氢氧化铝沉淀,故能观察到的现象为产生了白色胶状沉淀,该离子方程式为:AlO2- + CO2 + 2H2O ==Al(OH)3↓+HCO3-。
考点:铝及其化合物
点评:本题考查了铝及其化合物的相关计算,该题要求学生具有较强的数学分析能力,该题难度较大。

 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案