题目内容
在一个固定体积的密闭容器中,向容器中充入2mol A和1mol B,发生如下反应:2A(g)+B(g)?3C(g)+D(8),反应达到平衡时C的浓度为2mol/L.
(1)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为 (填“吸热”或“放热”)反应.
(2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为2mol/L的是 (用序号填空).
①4mol A+2mol B ②3molC+l mol D+1mol B
③3mol C+2mol D ④1.6molA+0.8mol B
(3)某温度下,向容器中加入3mol C和0.8mol D,反应达到平衡时C的浓度仍为1.2mol/L,则容器的容积V应大于 L,小于 L.
【答案】分析:(1)根据质量、摩尔质量、物质的量的关系结合方程式判断平衡的移动,从而判断是吸热反应还是放热反应;
(2)根据等效平衡判断;
(3)采用极限法求出C的物质的量,根据浓度、物质的量求出容器的体积.
解答:解:(1)根据质量守恒定律及反应方程式知,该反应反应前后气体的物质的量不变,气体的质量变小,所以平均摩尔质量减小,温度升高,平衡时混合气体的平均相对摩尔质量减小,说明平衡向正反应方向移动,所以正反应是吸热反应,
故答案为:吸热.
(2)根据等效平衡,把物质都换算成方程式一边的物质,且和初始加入的入2mol A和1mol B相等即可.
①4mol A+2mol B 与初始A、B浓度不同,故错.
②3molC+l mol D+1mol B换算成A、B,A、B浓度分别为2mol、2mol,与初始浓度不同,故错.
③3mol C+2mol D 换算成A、B,A、B浓度分别为2mol、1mol,D是固定,对气体无影响,故正确.
④1.6molA+0.8 mol B与初始浓度不同,故错.
故选③
(3)2A(g)+B(g) 3C(g)+D(S),
3C(g)+D(S),
C、D未反应 0 0 3mol 0.8 mol
D完全反应 1.6mol 0.8 mol 0.6mol 0
CD为反应时容器的体积V=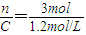 =2.5L;
=2.5L;
D完全反应时容器的体积V=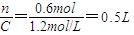 ;
;
故答案为:0.5L<V<2.5L
点评:本题考查的是等效平衡及化学平衡的有关计算,采用极限反应法求出C的物质的量,然后根据物质的量、物质的量浓度、体积之间的关系,从而求出容器体积,采用极限反应法是解(3)题的关键.
(2)根据等效平衡判断;
(3)采用极限法求出C的物质的量,根据浓度、物质的量求出容器的体积.
解答:解:(1)根据质量守恒定律及反应方程式知,该反应反应前后气体的物质的量不变,气体的质量变小,所以平均摩尔质量减小,温度升高,平衡时混合气体的平均相对摩尔质量减小,说明平衡向正反应方向移动,所以正反应是吸热反应,
故答案为:吸热.
(2)根据等效平衡,把物质都换算成方程式一边的物质,且和初始加入的入2mol A和1mol B相等即可.
①4mol A+2mol B 与初始A、B浓度不同,故错.
②3molC+l mol D+1mol B换算成A、B,A、B浓度分别为2mol、2mol,与初始浓度不同,故错.
③3mol C+2mol D 换算成A、B,A、B浓度分别为2mol、1mol,D是固定,对气体无影响,故正确.
④1.6molA+0.8 mol B与初始浓度不同,故错.
故选③
(3)2A(g)+B(g)
 3C(g)+D(S),
3C(g)+D(S),C、D未反应 0 0 3mol 0.8 mol
D完全反应 1.6mol 0.8 mol 0.6mol 0
CD为反应时容器的体积V=
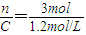 =2.5L;
=2.5L;D完全反应时容器的体积V=
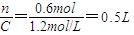 ;
;故答案为:0.5L<V<2.5L
点评:本题考查的是等效平衡及化学平衡的有关计算,采用极限反应法求出C的物质的量,然后根据物质的量、物质的量浓度、体积之间的关系,从而求出容器体积,采用极限反应法是解(3)题的关键.

练习册系列答案
相关题目