题目内容
(16分) 以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸铵[(NH4)2S2O8]和氧化铁红颜料, 原料的综合利用率较高。其主要流程如下:
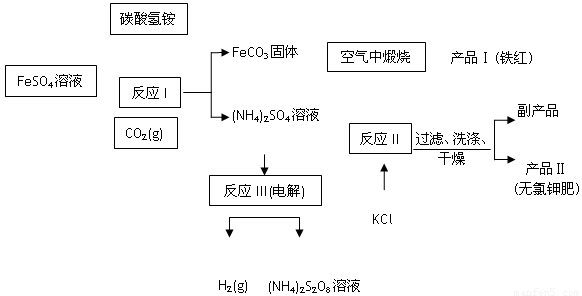
(1)①反应I前需在FeSO4 溶液中加入 ,以除去溶液中的Fe3+;
②反应I需控制反应温度低于35℃,其目的是 。
(2) ①反应II所得的副产品是 ;试写出该副产品的一种用途为 。
②检验产品II中是否含有氯化物杂质的实验操作是:取少量产品Ⅱ于试管中配成溶液,
。
(3)煅烧FeCO3生成产品I的化学反应方程式为________________________。实验室进行煅烧操作所需仪器除了酒精灯、泥三角、三脚架、玻璃棒外,还有 。
(4)反应III常被用于电解生产(NH4)2S2O8 (过二硫酸铵)。电解时均用惰性电极,阳极 发生的电极反应可表示为: 。
(1)①铁屑 (2分) ②防止NH4HCO3 分解(或减少Fe2+的水解 )(2分)
(2)①氯化铵 (或NH4Cl) (2分); 化肥或电解液或焊药 (2分)
②滴加过量Ba(NO3)2溶液,过滤后向滤液滴加AgNO3溶液 (2分)
(3)4FeCO3 + O2
 2Fe2O3 + 4CO2 (2分)
坩埚、坩埚钳 (2分)
2Fe2O3 + 4CO2 (2分)
坩埚、坩埚钳 (2分)
(4) 2SO42--2e-=S2O82- (2分)
【解析】

 小题狂做系列答案
小题狂做系列答案