题目内容
(7分) 某实验小组为探究ClO-、I2、SO42-在酸性条件下的氧化性强弱,设计实验如下:
实验①:在淀粉碘化钾溶液中加入少量次氯酸钠溶液,并加入少量的稀硫酸,溶液立即变蓝;
实验②:向实验①的溶液中加入4 ml 0.5 mol/L的亚硫酸钠溶液,蓝色恰好完全褪去。
(1)写出实验①中发生反应的离子方程式 。
(2)实验②中化学反应转移电子的物质的量是 。
(3)以上实验说明,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是 。
(7分)(1)ClO-+ H++2I—= I2 +Cl-+ H2O (2)0.004mol (3)ClO->I2>SO42-
【解析】
试题分析:(1)次氯酸钠具有强氧化性,能把碘化钾氧化生成单质碘,反应的离子方程式是ClO-+ H++2I—= I2 +Cl-+ H2O。
(2)单质碘也具有氧化性,能把亚硫酸钠氧化生成硫酸钠,反应的化学方程式是I2+Na2SO3+H2O=Na2SO4+2HI。4 ml 0.5 mol/L的亚硫酸钠溶液中溶质的物质的量是2×10-3mol,反应中硫元素的化合价从+4价升高到+6价,失去2个电子,所以实验②中化学反应转移电子的物质的量是2×10-3mol×2=4×10-3mol。
(3)由于在氧化还原反应中,氧化剂的氧化性强于氧化产物的,所以根据以上两个反应可知,在酸性条件下ClO-、I2、SO42-的氧化性由弱到强的顺序是ClO->I2>SO42-。
考点:考查离子方程式的书写、氧化还原反应的有关计算和氧化性强弱判断
点评:利用氧化还原反应判断有关物质的氧化性强弱顺序关键是准确判断出氧化剂、还原剂、氧化产物以及还原产物。然后依据氧化剂的氧化性强于氧化产物的,还原剂的还原性强于还原产物的即可。

 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。

发生的反应如下:
CH3CH2CH2CH2OH CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:
将6.0 g Na2 Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃,在E中收集90℃以下的馏分。
将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0 g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由______________________。
(2)加入沸石的作用是________。若加热后发现未加沸石,应采取的正确方法是________。
(3)上述装置图中,B仪器的名称是________,D仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________(填正确答案标号)。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分离水时,水在________层(填“上”或“下”)。
(6)反应温度应保持在90~95℃,其原因是__________________________________。
 如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.
如图装置可用于多项定量实验.图中夹持固定装置已略去,甲有刻度,供量气用.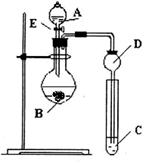
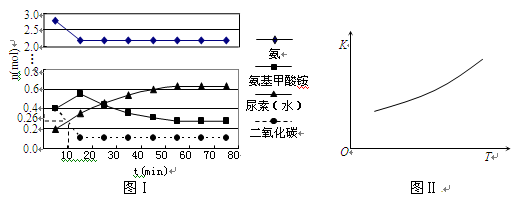
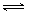 H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1
H2O(l)+H2NCONH2 (l) △H=-103.7 kJ·mol-1