题目内容
【题目】我国规定饮用水质量标准必须符合下列要求:
pH | 6.5~8.5 |
Ca2+、Mg2+总浓度 | <0.0045 mol·L-1 |
细菌总数 | <100个·mL-1 |
以下是源水处理成自来水的工艺流程示意图: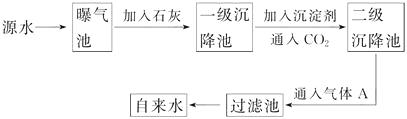
(1)源水中含Ca2+、Mg2+、HCO、Cl-等,加入石灰后有Ca(OH)2生成,进而发生若干复分解反应,写出其中一个离子方程式?
(2)凝聚剂除去悬浮固体颗粒的过程(填写编号)。
①只是物理过程 ②只是化学过程 ③是物理和化学过程
FeSO4·7H2O是常用的凝聚剂,它在水中最终生成沉淀。
(3)通入CO2的目的是。
(4)气体A的作用是 , 这种作用是基于气体A和水反应的产物具有性。
(5)下列物质中,可以作为气体A的代用品(填写编号)。
①Ca(ClO)2 ②NH3(液) ③K2FeO4 ④SO2
【答案】
(1)
Ca2++HCO+OH-=CaCO3↓+H2O
(2)③;胶状Fe(OH)3
(3)除Ca2+ , 调pH
(4)杀菌消毒;强氧化
(5)①③
【解析】凝聚剂要除去固体悬浮颗粒,首先要水解生成胶体再吸附杂质,有化学变化和物理过程。CO2气体的作用是除Ca2+ , 改变溶液的pH。根据气体A具有强氧化性,可知作代用品的可以是①③。

【题目】近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,火力发电厂释放出大量的NOx、SO2和CO2等气体也是其原因,现在对其中的一些气体进行了一定的研究:
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染.
已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H=﹣574kJ/mol
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=﹣1160kJ/mol
③H2O(g)=H2O(l)△H=﹣44.0kJ/mol
写出 CH4(g)与 NO2(g)反应生成 N2(g)、CO2(g)和 H2O(l)的热化学方程式: .
(2)汽车尾气中含有CO、NO2等有毒气体,对汽车加装尾气净化装置,可使有毒气体转化为无毒气体.4CO(g)+2NO2(g)4CO2(g)+N2(g)△H=﹣1200kJmol﹣1
对于该反应,温度不同(T2>T1)、其他条件相同时,下列图象正确的是(填代号).
(3)用活性炭还原法也可以处理氮氧化物,某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)N2(g)+CO2(g)△H=a kJ/mol
在T1℃时,反应进行到不同时间测得各物质的量浓度如表:
时间/min | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.3 0 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0﹣20min的平均反应速率v(NO)=;计算该反应的平衡常数K= .
②30min后,只改变某一条件,根据表的数据判断改变的条件可能是(填字母代号).
A.通入一定量的CO2 B.加入合适的催化剂
C.适当缩小容器的体积 D.通入一定量的NO
E.加入一定量的活性炭
③若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率(填“升高”或“降低”),a0(填“>”或“<”).
(4)温度T1和T2时,分别将0.50mol CH4和1.2mol NO2充入1L的密闭容器中发生反应:CH4(g)+2NO2(g)N2(g)+CO2(g)+2H2O(g)△H=bkJ/mol.测得有关数据如表:
温度 | 时间/min | 0 | 10 | 20 | 40 | 50 |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 /td> | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | x | 0.15 |
下列说法正确的是
A.T1>T2 , 且b>0
B.当温度为T2、反应进行到40min时,x>0.15
C.温度为T2时,若向平衡后的容器中再充入0.50mol CH4和1.2mol NO2 , 重新达到平衡时,n(N2)<0.70mol
D.温度为T1时,若起始时向容器中充入0.50mol CH4(g)、0.50molNO2(g)、1.0mol N2(g)、2.0molCO2(g)、0.50molH2O(g),反应开始时,ν(正)>ν(逆)