题目内容
【题目】Ⅰ.已知常温下,H2SO3的电离常数为Kal=1.54×10-2,Ka2=1.02×10-7,H2CO3的电离常数为Kal=4.30×10-7,Ka2=5.60×10-11。
(1)下列微粒可以大量共存的是________(填字母)。
a.CO![]() 、HSO
、HSO![]() b.HCO
b.HCO![]() 、HSO
、HSO![]()
c.SO![]() 、HCO
、HCO![]() d.H2SO3、HCO
d.H2SO3、HCO![]()
(2)已知NaHSO3溶液显酸性,解释原因:_____________________________;
NaHSO3的稀溶液中各离子浓度从大到小的排列顺序是_____________________________。
(3)浓度均为0.1 mol·L-1的Na2SO3和Na2CO3的混合溶液中,SO![]() 、CO
、CO![]() 、HSO
、HSO![]() 、HCO
、HCO![]() 浓度从大到小的顺序为____________________________。
浓度从大到小的顺序为____________________________。
(4)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_______________________。
Ⅱ.Na2S2O5(焦亚硫酸钠)是常见的食品抗氧化剂之一。
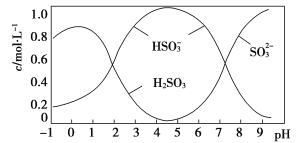
(5)将0.5 mol Na2S2O5溶于水配成1 L溶液,该溶液pH=4.5。溶液中部分微粒浓度随溶液酸碱性变化情况如图所示。写出Na2S2O5溶于水的化学方程式:____________________________;当溶液pH小于1后,溶液中H2SO3的浓度变小,其原因可能是________________________。pH=3时,溶液中主要含硫粒子浓度的大小关系为________。
(6)已知:Ksp(BaSO4)=1.0×10-10,Ksp(BaSO3)=5.0×10-7。将部分被空气氧化的该溶液的pH调为10,向溶液中滴加BaCl2溶液使SO![]() 沉淀完全[c(SO
沉淀完全[c(SO![]() )≤1.0×10-5mol·L-1],此时溶液中c(SO
)≤1.0×10-5mol·L-1],此时溶液中c(SO![]() )≤________mol·L-1。
)≤________mol·L-1。
【答案】Ⅰ.(1)bc (2)HSO![]() 的电离程度大于水解程度
的电离程度大于水解程度
c(Na+)>c(HSO![]() )>c(H+)>c(SO
)>c(H+)>c(SO![]() )>c(OH-)
)>c(OH-)
(3)c(SO![]() )>c(CO
)>c(CO![]() )>c(HCO
)>c(HCO![]() )>c(HSO
)>c(HSO![]() )
)
(4)H2SO3+HCO![]() =HSO
=HSO![]() +CO2↑+H2O
+CO2↑+H2O
Ⅱ.(5)Na2S2O5+H2O=2NaHSO3 H2SO3分解产生SO2或H2SO3被氧化 HSO![]() 的浓度大于H2SO3的
的浓度大于H2SO3的
(6)0.05
【解析】Ⅰ.(1)已知Ka越大酸性越强,由于HCO![]() 的酸性小于HSO
的酸性小于HSO![]() 的酸性,所以HCO
的酸性,所以HCO![]() 与SO
与SO![]() 不反应,即bc能共存。(2)HSO
不反应,即bc能共存。(2)HSO![]() 的电离程度大于水解程度使得溶液显酸性;HSO
的电离程度大于水解程度使得溶液显酸性;HSO![]() 发生电离,c(Na+)>c(HSO
发生电离,c(Na+)>c(HSO![]() ),水也能电离出H+,因此c(H+)>c(SO
),水也能电离出H+,因此c(H+)>c(SO![]() ),由于溶液显酸性,电离大于水解,所以c(SO
),由于溶液显酸性,电离大于水解,所以c(SO![]() )>c(OH-),即c(Na+)>c(HSO
)>c(OH-),即c(Na+)>c(HSO![]() )>c(H+)>c(SO
)>c(H+)>c(SO![]() )>c(OH-)。(3)根据题给Ka可知,水解程度CO
)>c(OH-)。(3)根据题给Ka可知,水解程度CO![]() >SO
>SO![]() >HCO
>HCO![]() >HSO
>HSO![]() ,则溶液中离子浓度:c(SO
,则溶液中离子浓度:c(SO![]() )>c(CO
)>c(CO![]() )>c(HCO
)>c(HCO![]() )>c(HSO
)>c(HSO![]() )。(4)由题干数据可知H2SO3的二级电离常数小于H2CO3的一级电离常数,所以酸性H2SO3>H2CO3>HSO
)。(4)由题干数据可知H2SO3的二级电离常数小于H2CO3的一级电离常数,所以酸性H2SO3>H2CO3>HSO![]() ,所以反应的主要离子方程式为H2SO3+HCO
,所以反应的主要离子方程式为H2SO3+HCO![]() =HSO
=HSO![]() +CO2↑+H2O。Ⅱ.(5)据图可知,pH=4.5时,溶液中主要有亚硫酸氢根离子,所以Na2S2O5溶于水的化学方程式为Na2S2O5+H2O=2NaHSO3。当溶液pH小于1时,溶液中主要有亚硫酸存在,但亚硫酸不稳定,易分解生成二氧化硫,亚硫酸被氧化也会导致浓度变小。根据图示,pH=3时,HSO
+CO2↑+H2O。Ⅱ.(5)据图可知,pH=4.5时,溶液中主要有亚硫酸氢根离子,所以Na2S2O5溶于水的化学方程式为Na2S2O5+H2O=2NaHSO3。当溶液pH小于1时,溶液中主要有亚硫酸存在,但亚硫酸不稳定,易分解生成二氧化硫,亚硫酸被氧化也会导致浓度变小。根据图示,pH=3时,HSO![]() 的浓度大于H2SO3的。(6)根据Ksp(BaSO4)=c(Ba2+)·c(SO
的浓度大于H2SO3的。(6)根据Ksp(BaSO4)=c(Ba2+)·c(SO![]() ),可知需要c(Ba2+)=
),可知需要c(Ba2+)=![]() =
=![]() =1.0×10-5(mol·L-1),则溶液中SO
=1.0×10-5(mol·L-1),则溶液中SO![]() 的最大浓度c(SO
的最大浓度c(SO![]() )=
)=![]() =
=![]() =0.05 (mol·L-1)。
=0.05 (mol·L-1)。

 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案 互动课堂系列答案
互动课堂系列答案