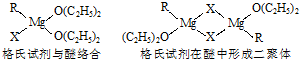
题目内容
下列性质的比较中,正确的是( )
分析:A.氨气分子之间存在氢键,沸点高于同主族其它氢化物;
B.电子层结构相同核电荷数越大离子半径越小,最外层电子数相同电子层越多离子半径越大;
C.非金属性越强氢化物越稳定,甲烷的稳定性比较PH3强;
D.磷酸是中强酸.
B.电子层结构相同核电荷数越大离子半径越小,最外层电子数相同电子层越多离子半径越大;
C.非金属性越强氢化物越稳定,甲烷的稳定性比较PH3强;
D.磷酸是中强酸.
解答:解:A.氨气分子之间存在氢键,沸点高于同主族其它氢化物,故A错误,故A错误;
B.电子层结构相同核电荷数越大离子半径越小,最外层电子数相同电子层越多离子半径越大,故离子半径Al3+<Na+<K+<S2-,故B正确;
C.非金属性越强氢化物越稳定,故稳定性PH3<H2O<HF,甲烷的稳定性比较PH3强,故C错误;
D.磷酸是中强酸,酸性比硝酸弱,故D错误;
故选B.
B.电子层结构相同核电荷数越大离子半径越小,最外层电子数相同电子层越多离子半径越大,故离子半径Al3+<Na+<K+<S2-,故B正确;
C.非金属性越强氢化物越稳定,故稳定性PH3<H2O<HF,甲烷的稳定性比较PH3强,故C错误;
D.磷酸是中强酸,酸性比硝酸弱,故D错误;
故选B.
点评:本题考查同主族性质的递变规律,难度中等,注意规律的掌握与甲烷稳定性、氨气沸点的特殊性.

练习册系列答案
相关题目