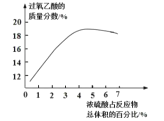
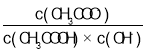题目内容
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X的一种单质可以供给生物呼吸,Y原子的最外层有1个电子,Z是地壳中含量最多的金属元素,W与X位于同一主族。下列说法正确的是( )
A.原子半径:![]()
B.由X、Y组成的化合物是共价化合物
C.W的简单气态氢化物的热稳定性比X的强
D.Z的最高价氧化物对应水化物的碱性比Y的强
【答案】A
【解析】
X的一种单质可以供给生物呼吸,故X为O,因Y的原子序数比X大且为短周期元素,结合Y原子的最外层有1个电子可知,Y为Na,Z 是地壳中含量最多的金属元素,故Z为Al,W与X位于同一主族,故W为S,以此解答。
A.O原子核外电子层数最少,其半径最小,Na、Al、S为同周期元素,从左至右原子半径逐渐减小,故半径:r(Na)> r(Al)> r(S)> r(O),故A正确;
B.O与Na形成的化合物均为离子化合物,故B错误;
C.因非金属性:O>S,因此其简单氢化物的稳定性:H2O>H2S,故C错误;
D.因金属性:Na>Al,因此其最高价氧化物对应水化物的碱性:NaOH>Al(OH)3,故D错误;
故答案为:A。

练习册系列答案
相关题目