题目内容
丙烷在燃烧时能放出大量的热,它也是液化石油气的主要成分,作为能源应用于人们的日常生产和生活。已知:
①2C3H8(g) +7O2(g) = 6CO(g)+8H2O(g) △H = -2389.8 kJ/mol
②2CO(g) + O2(g) = 2CO2(g) △H = -566 kJ/mol
③H2O(l) = H2O(g) △H =" +" 44.0 kJ/mol
(1)写出C3H8燃烧时燃烧热的热化学方程式 。
(2)C3H8在不足量的氧气里燃烧,生成CO、CO2、H2O(g),将所有的产物通入一个体积固定的密闭
容器中,在一定条件下发生如下可逆反应: CO(g) + H2O(g) CO2(g) + H2(g)
CO2(g) + H2(g)
该反应的平衡常数与温度的关系如下表:
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
保持温度为800℃,在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,充分反应直至达到平衡。
| | H2O | CO | CO2 | H2 |
| 甲 (质量/g) | 1.8 | 8.4 | a | 1 |
| 乙 (质量/g) | 1.8 | 2.8 | 0 | 0 |
①起始时,要使甲容器中反应向正反应方向进行,则a的取值范围是 ;达到平衡
时,乙容器中CO的转化率为 。
②如图表示上述甲容器中反应在t1时刻达到平衡,在t2时刻因改变某一个条件而发生变化的情况。则t2时刻改变的条件可能是 、 (答两个要点即可)。

(3)CO2可用NaOH溶液吸收得到Na2CO3或NaHCO3。
① Na2CO3溶液中离子浓度由大到小的顺序为 ;
② 已知25℃时,H2CO3的电离平衡常数K1 = 4.4×10-7 mol/L、K2 = 4.7×10-11 mol/L,当Na2CO3溶液的pH为11时, 溶液中c(HCO3-)∶c(CO32-) = 。
③ 0.1 mol/L Na2CO3溶液中c(OH-) - c(H+ ) = [用含c(HCO3-)、c(H2CO3)的符号表示]。
(1)C3H8(g) +5O2(g) = 3CO2(g)+4H2O(l) △H = -2219.9 kJ/mol
(2)① 0 ≤a <2.64 ; 50%
② 降低温度、降低H2浓度、增大H2O(g)浓度
(3)①c(Na+) > c(CO32-) > c(OH-) > c(HCO3-) > c(H+)
② 1 : 4.7
③c(HCO3-) + 2c(H2CO3)
解析试题分析:(1)燃烧热是1mol的物质完全燃烧产生稳定的氧化物时所放出热量的化学方程式。将(①+②×3- ③×8)÷2,整理可得:C3H8(g)+5O2(g) =3CO2(g)+4H2O(l) △H =-2219.9 kJ/mol。(2)①该反应是个反应前后气体体积相等的反应。在800℃时化学平衡常数为1.对于甲来说,在反应开始时,若CO2的质量为0,则反应一定正向进行,n(H2O)="0.1mol;" n(CO)="0.3mol;" n(CO2)="a/44mol," n(H2)=0.5mol.)若要使反应正向进行。起始时,则 ;
; 。解得0<a<2.64.
。解得0<a<2.64.
对于乙来说:开始时n(H2O)=0.1mol;n(CO)="0.1mol" ;n(CO2)="0" ;n(H2)=0;假设在反应的过程中CO转化的物质的量为x,则在平衡时各种物质的物质的量为:n(H2O)="(0.1-x)mol;" n(CO)="(0.1-x)mol" ; %n(CO2)=xmol;n(H2)=xmol。由于该反应是反应前后气体体积相等的反应,而且在800℃时的平衡常数为1.所以(0.1-x)×(0.1-x)=x2.解得x=0.05mol.所以CO的转化率为0.05÷0.1×100%=50%。②由化学平衡常数以温度的关系可知:升高温度,化学平衡产生减小。说明升高温度,化学平衡向逆反应方向移动。根据平衡移动原理,升高温度,化学平衡向吸热反应方向移动。逆反应方向为吸热反应,所以该反应的正反应为放热反应。由于在平衡后改变某一条件,时,c(CO2)增大,c(CO)减小,所以改变外界条件使平衡正向移动,可以通过降低温度的方法来实现。因为反应前后气体的体积相等,所以改变压强,化学平衡不发生移动。若增大H2O蒸汽的浓度或减小H2的浓度都会使化学平衡正向移动。因此改变的外界条件是降低温度、降低H2浓度、增大H2O(g)浓度。(3)①Na2CO3是强碱弱酸盐。Na2CO3=2Na++CO32-,CO32-会发生水解反应:CO32-+ H2O HCO3-+ OH-消耗水电离产生的H+,促进水的电离。产生的HCO3-会继续水解:HCO3-+ H2O
HCO3-+ OH-消耗水电离产生的H+,促进水的电离。产生的HCO3-会继续水解:HCO3-+ H2O H2CO3+ OH-。当最终达到平衡时c(OH-)> c(HCO3-) >c(H+) .所以在Na2CO3溶液中离子浓度由大到小的顺序为c(Na+) > c(CO32-) > c(OH-) > c(HCO3-) > c(H+)。②HCO3-
H2CO3+ OH-。当最终达到平衡时c(OH-)> c(HCO3-) >c(H+) .所以在Na2CO3溶液中离子浓度由大到小的顺序为c(Na+) > c(CO32-) > c(OH-) > c(HCO3-) > c(H+)。②HCO3- H++ CO32-
H++ CO32- 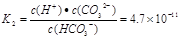 .
.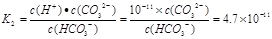 ;
;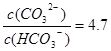 ;
; 。③Na2CO3溶液显碱性,根据质子守恒可得c(OH-)=c(H+ )(始) = c(H+ )+ c(HCO3-)+2(H2CO3)。所以c(OH-)-c(H+ ) = c(HCO3-)+2(H2CO3)。
。③Na2CO3溶液显碱性,根据质子守恒可得c(OH-)=c(H+ )(始) = c(H+ )+ c(HCO3-)+2(H2CO3)。所以c(OH-)-c(H+ ) = c(HCO3-)+2(H2CO3)。
考点:考查热化学方程式的书写、物质的转化率、平衡移动的措施、离子浓度的大小比较的知识。

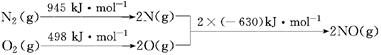
合成氯是人类研究的重要课题,目前工业合成氨的原理为:
N2(g)+3H2(g)  2NH3(g) ΔH=-93.0kJ/mol
2NH3(g) ΔH=-93.0kJ/mol
(1)某温度下,在2 L密闭容器中发生上述反应,测得数据如下
| 时间/h 物质的量/mol | 0 | 1 | 2 | 3 | 4 |
| N2 | 2.0 | 1.83 | 1.7 | 1.6 | 1.6 |
| H2 | 6.0 | 5.49 | 5.1 | 4.8 | 4.8 |
| NH3 | 0 | 0.34 | 0.6 | 0.8 | 0.8 |
①0~2 h内,v(N2)= 。
②平衡时,H2的转化率为____;该温度下,反应2NH3(g)
 N2(g)+3H2(g)的平衡常数K= 。
N2(g)+3H2(g)的平衡常数K= 。③若保持温度和体积不变,起始投入的N2、H2、NH3的物质的量分别为a mol、b mol、c mol,达到平衡后,NH3比的浓度与上表中相同的为 (填选项字母)。
A.a=l、b=3.c=0 B.a=4、b=12、c=0
C.a=0、b=0.c=4 D.a=l、b=3、c=2
(2)另据报道,常温、常压下,N2在掺有少量氧化铁的二氧化钛催化剂表面能与水发生反应,生成NH3和O2。已知:H2的燃烧热ΔH=-286kJ/mol,则陪制NH3反应的热化学方程式为 。
(3)采用高质子导电性的SCY陶瓷(能传递H'),通过电解法也可合成氨,原理为:
N2(g)+3H2(g)
 2NH3(g)。在电解法合成氨的过程申,应将N2不断地通入 ___极,该电极反应式为 。
2NH3(g)。在电解法合成氨的过程申,应将N2不断地通入 ___极,该电极反应式为 。 根据下列条件计算有关反应的焓变:
(1)已知:Ti(s)+2Cl2(g)=TiCl4(l)ΔH=-804.2 kJ·mol-1
2Na(s)+Cl2(g)=2NaCl(s) ΔH=-882.0 kJ·mol-1
Na(s)=Na(l) ΔH=+2.6 kJ·mol-1
则反应TiCl4(l)+4Na(l)=Ti(s)+4NaCl(s)的ΔH=________ kJ·mol-1。
(2)已知下列反应数值:
| 反应序号 | 化学反应 | 反应热 |
| ① | Fe2O3(s)+3CO(g)= 2Fe(s)+3CO2(g) | ΔH1=-26.7 kJ·mol-1 |
| ② | 3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g) | ΔH2=-50.8 kJ·mol- |
| ③ | Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) | ΔH3=-36.5 kJ·mol-1 |
| ④ | FeO(s)+CO(g)=Fe(s)+CO2(g) | ΔH4 |
则反应④的ΔH4=____________ kJ·mol-1。
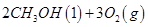 =
= mol
mol
 =
=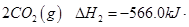 mol
mol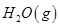 =
=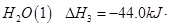 mol
mol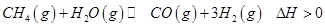
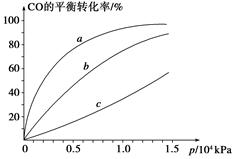
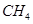 的平衡转化率与温度、压强的关系如图a。则
的平衡转化率与温度、压强的关系如图a。则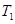
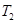 (填“<”、“>”或“=",下同);A、B、C三点处对应平衡常数(
(填“<”、“>”或“=",下同);A、B、C三点处对应平衡常数(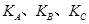 )的大小关系为 ;
)的大小关系为 ;
 通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 (填序号)。
通入容积为1L的定容密闭容器中发生反应,能说明该反应已经达到平衡状态的是 (填序号)。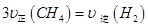
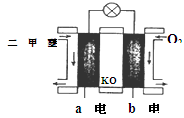
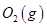 、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为 。
、KOH(aq)设计成如图b所示的电池装置,则该电池负极的电极反应式为 。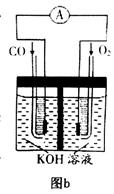

 CH3OCH3+H2O
CH3OCH3+H2O CH3OCH3(g)+CO2(g) △H=-247kJ/mol
CH3OCH3(g)+CO2(g) △H=-247kJ/mol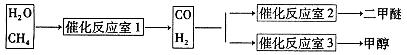
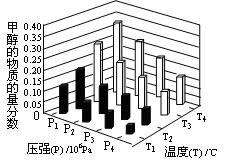
 CH3OH(g)达到化学平衡状态。
CH3OH(g)达到化学平衡状态。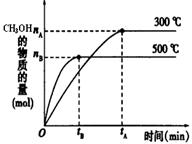

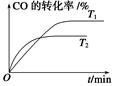
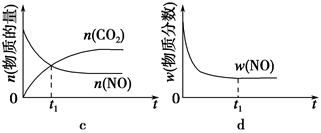
 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线如图所示。

 N2O4(g) ΔH2=-56.9 kJ·mol-1
N2O4(g) ΔH2=-56.9 kJ·mol-1