题目内容
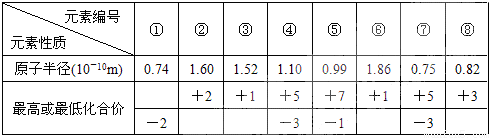
现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
回答下列问题:
(1)①在元素周期表中的位置是(周期、族) ;
(2)比较④和⑦的氢化物的稳定性(用化学式表示) 。
(4分)(1)第二周期第Ⅵ A族;(2分)(2)NH3>PH3(2分)
解析试题分析:电子层越多,半径越大,同周期从左向右原子半径在减小,最高正价在增大,最高正价等于族序数,由短周期元素的数据可知,①为O,②为Mg,③为Li,④为P,⑤为Cl,⑥为Na,⑦为N,⑧为B,
(1)①为O,在元素周期表中的位置是第二周期第Ⅵ A族。
(2)④⑦同主族,④的原子半径大,则原子序数大,④和⑦的氢化物的稳定性是NH3>PH3。考点:原子结构与元素周期率的关系
点评:本题考查原子结构与元素周期律,熟悉原子半径、化合价的变化规律是解答本题的关键,题目难度不大,⑧为学生解答的易错点。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案(15分)现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
| | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | | +2 | +1 | +5 | +7 | +1 | +5 | +3 |
| -2 | | | -3 | -1 | | -3 | |
(1)③的元素符号是 ,⑧的元素名称是 。①在元素周期表中的位置是(周期、族) 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 ,
名称是 ;碱性最强的化合物的电子式是: ;该化合物中含有的化学键 (选填“离子键”、“极性共价键”、“非极性共价键”)
(3)比较④和⑦的氢化物的稳定性(用化学式表示) 。
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:
。
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:
。
现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
|
|
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
|
原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
|
最高或最低化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
|
-2 |
|
|
-3 |
-1 |
|
-3 |
回答下列问题:
(1)③的元素符号是 ,①在元素周期表中的位置是(周期、族) 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是___ ____;
名称是 ;
(3)比较④和⑦的氢化物的稳定性 (用化学式回答)
(4)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式 。