题目内容
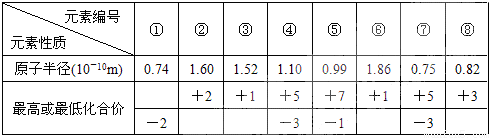
现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
|
|
① |
② |
③ |
④ |
⑤ |
⑥ |
⑦ |
|
原子半径(10-10m) |
0.74 |
1.60 |
1.52 |
1.10 |
0.99 |
1.86 |
0.75 |
|
最高或最低化合价 |
|
+2 |
+1 |
+5 |
+7 |
+1 |
+5 |
|
-2 |
|
|
-3 |
-1 |
|
-3 |
回答下列问题:
(1)③的元素符号是 ,①在元素周期表中的位置是(周期、族) 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是___ ____;
名称是 ;
(3)比较④和⑦的氢化物的稳定性 (用化学式回答)
(4)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式 。
(1)Li ;第二周期第ⅥA族 (2)HClO4、高氯酸
(3)NH3 > PH3(4)Mg(OH)2 + 2H+=Mg2+ + 2H2O
【解析】
试题分析:从图表数据可知,+1价的③、⑥,一定是碱金属Li和Na,而原子半径⑥>③,故③应为第IA族第二周期的Li,⑥为三周期的Na元素;④和⑦最高正价均为+5,负价一致,故为第VA族元素,因原子半径④>⑦,故④为第三周期第VA族的P元素,⑦为N元素;从化合价可推出⑤属于卤素,由于短周期F元素无正价,故⑤为氯元素,位于第VIIA族第三周期;①的最低负价为-价,无正价,则①应为第二周期的O元素,②最高正价+2价,无负价,只能是ⅡA族元素,且原子半径②<⑥,为第三周期的Mg元素。
(1)③的元素符号是Li;①在元素周期表中的位置是第二周期第ⅥA族。
(2)非金属性越强,最高价氧化物的水化物的酸性越强。则在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,名称是高氯酸。
(3)非金属性越强,氢化物的稳定性越强,所以④和⑦的氢化物的稳定性是NH3>PH3。
(4)②最高价氧化物对应水化物是氢氧化镁,⑤的氢化物水溶液是盐酸,二者反应的离子方程式是Mg(OH)2 + 2H+=Mg2+ + 2H2O。
考点:考查元素的位置结构性质关系及应用
点评:该题是中等难度的试题,也是高考中的常见考点和题型。本题从化合价和原子半径的角度来判断元素的种类,要求学生在学习中要注意把握相关周期律的递变规律,根据元素所在周期表中的位置,元素对应原子、单质以及化合物的结构和性质,结合元素周期律的递变规律解答该题。

(15分)现有8种元素的性质、数据如下表所列,它们属于第二或第三周期。
| | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | | +2 | +1 | +5 | +7 | +1 | +5 | +3 |
| -2 | | | -3 | -1 | | -3 | |
(1)③的元素符号是 ,⑧的元素名称是 。①在元素周期表中的位置是(周期、族) 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是 ,
名称是 ;碱性最强的化合物的电子式是: ;该化合物中含有的化学键 (选填“离子键”、“极性共价键”、“非极性共价键”)
(3)比较④和⑦的氢化物的稳定性(用化学式表示) 。
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:
。
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:
。