题目内容
在相同温度和压强下,等质量的下列气体所占体积最大的是( )
| A、N2 | B、O2 | C、CO2 | D、Cl2 |
分析:相同温度和相同压强下,气体摩尔体积相等,根据V=nVm=
Vm判断体积大小.
| m |
| M |
解答:解:相同温度和相同压强下,气体摩尔体积相等,根据V=nVm=
Vm知,相同质量、气体摩尔体积时,气体体积大小与摩尔质量成反比,氮气的摩尔质量是28g/mol,氧气的摩尔质量是32g/mol,二氧化碳的摩尔质量是44g/mol,氯气的摩尔质量是71g/mol,所以气体体积最大的是氮气,故选A.
| m |
| M |
点评:本题考查了阿伏伽德罗定律及推论,根据公式中气体的摩尔质量与体积之间的关系式分析解答即可,熟练掌握基本公式是解本题关键,难度不大.

练习册系列答案
相关题目
在相同温度和压强下,对反应CO2(g)+H2(g)?CO(g)+H2O(g)进行甲、乙、丙、丁四组实验,实验起始时放入容器内各组分的物质的量见表:
|
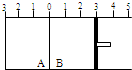 如图所示,温度不变时某容器分隔成A、B两部分,A、B容器之间的密封挡板可以左右自由移动,B容器右侧有可移动的活塞.现在A容器中充入2mol SO2和1mol O2,在B容器中充入2mol SO3(g)和1mol N2,在相同温度和压强下可发生可逆反应:2SO2(g)+O2(g)?2SO3(g).下列说法正确的是( )
如图所示,温度不变时某容器分隔成A、B两部分,A、B容器之间的密封挡板可以左右自由移动,B容器右侧有可移动的活塞.现在A容器中充入2mol SO2和1mol O2,在B容器中充入2mol SO3(g)和1mol N2,在相同温度和压强下可发生可逆反应:2SO2(g)+O2(g)?2SO3(g).下列说法正确的是( )| A、平衡后A、B两容器的体积相等 | B、平衡后A、B两容器中的SO3的体积分数相等 | C、平衡后A、B两容器中的SO2的转化率相等 | D、平衡后容器中SO2的物质的量:A<B |