题目内容
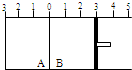 如图所示,温度不变时某容器分隔成A、B两部分,A、B容器之间的密封挡板可以左右自由移动,B容器右侧有可移动的活塞.现在A容器中充入2mol SO2和1mol O2,在B容器中充入2mol SO3(g)和1mol N2,在相同温度和压强下可发生可逆反应:2SO2(g)+O2(g)?2SO3(g).下列说法正确的是( )
如图所示,温度不变时某容器分隔成A、B两部分,A、B容器之间的密封挡板可以左右自由移动,B容器右侧有可移动的活塞.现在A容器中充入2mol SO2和1mol O2,在B容器中充入2mol SO3(g)和1mol N2,在相同温度和压强下可发生可逆反应:2SO2(g)+O2(g)?2SO3(g).下列说法正确的是( )| A、平衡后A、B两容器的体积相等 | B、平衡后A、B两容器中的SO3的体积分数相等 | C、平衡后A、B两容器中的SO2的转化率相等 | D、平衡后容器中SO2的物质的量:A<B |
分析:容器中充入2mol SO2和1mol O2和充入2mol SO3(g)建立的平衡是等效的,但是B中多加入了1mol氮气,所以当达到平衡时,A体系的体积小于B中的体积,B中的平衡相当于是在A平衡的基础上减小压强建立的,可以根据压强对化学平衡移动的影响来来回答.
解答:解:A、容器中充入2mol SO2和1mol O2和充入2mol SO3(g)建立的平衡是等效的,但是B中多加入了1mol氮气,所以平衡后A、B两容器的体积不会相等,故A错误;
B、B中相对于A中的气体而言,B中的压强小于A中气体的压强,所以平衡后A、B两容器中的SO3的体积分数是A中的大,故B错误;
C、B中相对于A中的气体而言,B中的压强小于A中气体的压强,所以A中二氧化硫的转化率更大,故C错误;
D、B中相对于A中的气体而言,B中的压强小于A中气体的压强,所以B平衡相对于A的平衡逆向移动了,所以B中平衡后容器中SO2的物质的量增加了,故D正确.
故选D.
B、B中相对于A中的气体而言,B中的压强小于A中气体的压强,所以平衡后A、B两容器中的SO3的体积分数是A中的大,故B错误;
C、B中相对于A中的气体而言,B中的压强小于A中气体的压强,所以A中二氧化硫的转化率更大,故C错误;
D、B中相对于A中的气体而言,B中的压强小于A中气体的压强,所以B平衡相对于A的平衡逆向移动了,所以B中平衡后容器中SO2的物质的量增加了,故D正确.
故选D.
点评:本题考查学生影响化学平衡的移动和化学平衡的建立方面的知识,综合性强,难度不大.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
 Ⅰ.在一定温度下,把2mol N2和6mol H2通入一个体积不变的密闭容器中(如图)发生反应:N2(g)+3H2(g)
Ⅰ.在一定温度下,把2mol N2和6mol H2通入一个体积不变的密闭容器中(如图)发生反应:N2(g)+3H2(g) 2NH3 (g)(正反应为放热反应)若反应达到平衡后,测得混和气体为7mol.据此回答下列问题:
2NH3 (g)(正反应为放热反应)若反应达到平衡后,测得混和气体为7mol.据此回答下列问题:
 I.高炉炼铁中发生的基本反应之一是FeO(s)+CO(g)?Fe(s)+CO2(g)△H>0.其平衡常数可表达为k=c(CO2)/c(CO),已知1100℃时,k=0.263.
I.高炉炼铁中发生的基本反应之一是FeO(s)+CO(g)?Fe(s)+CO2(g)△H>0.其平衡常数可表达为k=c(CO2)/c(CO),已知1100℃时,k=0.263. 2NH3 (g) (正反应为放热反应)
2NH3 (g) (正反应为放热反应) (1)若a = 1 mol,c =2 mol ,则b =____ mol,在此情况下,
(1)若a = 1 mol,c =2 mol ,则b =____ mol,在此情况下, Ⅱ.如图所示,温度不变时,把某容器分割成A.B两部分,A容器体积固定不变,B有可移动的活塞,现在A中充入2 mol SO2和1 mol O2,在B中充入2 mol SO3和 1 mol N2,在相同条件下发生可逆反应:
Ⅱ.如图所示,温度不变时,把某容器分割成A.B两部分,A容器体积固定不变,B有可移动的活塞,现在A中充入2 mol SO2和1 mol O2,在B中充入2 mol SO3和 1 mol N2,在相同条件下发生可逆反应: