题目内容
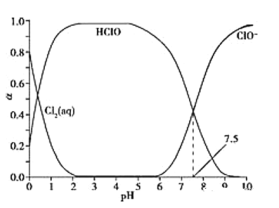
【题目】氯气可以用于制取漂白剂和自来水杀菌消毒。常温下,溶液中Cl2(aq)、HClO和ClO-物质的量分数(α)随pH变化的关系如图所示。
已知,Cl2(g)![]() Cl2(aq)K1=10-1.2
Cl2(aq)K1=10-1.2
Cl2(aq)+H2O![]() HClO+H++Cl-K2=10-3.4
HClO+H++Cl-K2=10-3.4
下列说法正确的是
A.Cl2(g)+H2O![]() 2H++ClO-+Cl-K3=10-10.9
2H++ClO-+Cl-K3=10-10.9
B.氯气通入水中,c(HClO)+c(ClO-)<c(H+)-c(OH-)
C.pH=7.0时漂白能力要比pH=6.0时要强
D.氯气处理自来水时,在夏天的杀菌消毒效果要比在冬天好
【答案】B
【解析】
A. Cl2(g)+H2O ![]() 2H++ClO-+Cl-,平衡常数的表达式为K3=
2H++ClO-+Cl-,平衡常数的表达式为K3=![]() ,在pH=7.5时,c(HClO)=c(ClO-),即K3=
,在pH=7.5时,c(HClO)=c(ClO-),即K3=![]() ,Cl2(g)
,Cl2(g) ![]() Cl2(aq) K1=
Cl2(aq) K1=![]() ,Cl2(aq)+H2O
,Cl2(aq)+H2O ![]() HClO+Cl-+H+,K2=
HClO+Cl-+H+,K2=![]() ,取pH=7.5,K3=K1×K2×c(H+)=10-1.2×10-3.4×10-7.5=10-12.1,故A错误;
,取pH=7.5,K3=K1×K2×c(H+)=10-1.2×10-3.4×10-7.5=10-12.1,故A错误;
B. 氯气通入水中,存在电荷守恒:c(H+)=c(Cl-)+c(ClO-)+c(OH-),得出:c(Cl-)+c(ClO-)=c(H+)-c(OH-),氯气与水反应:Cl2+H2O=HCl+HClO,根据物料守恒,c(Cl-)=c(HClO)+c(ClO-),带入上式,得出:c(HClO)+2c(ClO-)=c(H+)-c(OH-),因此有c(HClO)+c(ClO-)<c(H+)-c(OH-),故B正确;
C. 起漂白作用的是HClO,由图像可知,pH=7.0时,c(HClO)比pH=6.0小,因此pH=7.0时漂白能力要比pH=6.0时要弱,故C错误;
D. 夏天相比冬天温度高,并且HClO易分解;温度越高,HClO分解越快。所以,在夏天的杀菌消毒效果要比在冬天差,故D错误;
答案:B。

 名校课堂系列答案
名校课堂系列答案