题目内容
【题目】(I)FeCl3的水溶液呈___(填“酸性”、“碱性”或“中性”),原因是_____(用离子方程式表示);实验室配制FeCl3的水溶液时,需加入______;如果把FeCl3溶液蒸干,灼烧,最后得到的主要固体产物是________。
(II)某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①用0.10mol/L的标准盐酸润洗酸式滴定管2~3处
②取标准盐酸注入酸式滴定管至“0”刻度以上2~3mL处
③把盛有标准盐酸的酸式滴定管固定好,调节滴定管尖嘴使之充满溶液
④调节液面至“0”或“0”刻度以下,记下读数
⑤取20.00mL待测NaOH溶液注入洁净的锥形瓶中,并加入2~3滴甲基橙试液
⑥把锥形瓶放在滴定管的下面,用标准盐酸滴定至终点,记录滴定管读数
请回答下列问题:
(1)某次滴定时的滴定管中的液面如图所示,其读数为_______mL。

(2)根据下列数据:
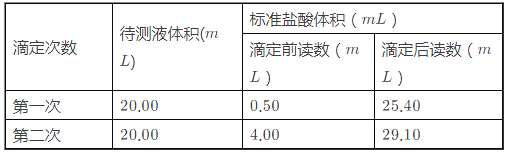
请计算待测烧碱溶液的浓度为______mol/L。
(3)下列实验操作会使实验结果偏高的是_______。
A.锥形瓶用待测液润洗后再注入待测液
B.酸式滴定管未用标准液润洗,便装入标准液
C.酸式滴定管滴定前俯视读数,滴定后仰视读数
D.酸式滴定管滴定前有气泡,滴定后无气泡
【答案】酸性 Fe3++3H2O![]() Fe(OH)3+3H+ 盐酸 Fe2O3 22.60 0.1250 ABCD
Fe(OH)3+3H+ 盐酸 Fe2O3 22.60 0.1250 ABCD
【解析】
(I)FeCl3是强酸弱碱盐,在水溶液中水解溶液呈酸性;根据盐的水解规律,结合水解产物的性质分析判断;
(II)(1)读数时目光平视,凹液面最低点与刻度线相切;
(2)先算出每一次消耗的标准酸溶液的体积,然后计算出消耗标准酸溶液的平均体积,利用H+、OH-的物质的量相等来计算;
(3)根据根据c(待测)=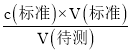 来分析。
来分析。
(I)FeCl3是强酸弱碱盐,在水溶液中Fe3+是水解反应,使溶液呈酸性,其水解离子方程式为:Fe3++3H2O![]() Fe(OH)3+3H+;实验室配制FeCl3的水溶液时,为了抑制三价Fe3+水解,常将FeCl3固体先溶于较浓的盐酸中;FeCl3溶液加热促进水解,产生Fe(OH)3和HCl,同时生成的HCl容易挥发,最后蒸干得到Fe(OH)3,将固体灼烧,Fe(OH)3发生分解反应产生Fe2O3和H2O,所以最后得到的固体产物为:Fe2O3;
Fe(OH)3+3H+;实验室配制FeCl3的水溶液时,为了抑制三价Fe3+水解,常将FeCl3固体先溶于较浓的盐酸中;FeCl3溶液加热促进水解,产生Fe(OH)3和HCl,同时生成的HCl容易挥发,最后蒸干得到Fe(OH)3,将固体灼烧,Fe(OH)3发生分解反应产生Fe2O3和H2O,所以最后得到的固体产物为:Fe2O3;
(II)(1)待测液的物质的量不变,读数时目光平视,凹液面最低点与刻度线相切,所以读数为22.60;
(2)第一次酸为25.42-0.52=24.90mL,第二次酸为29.17-4.07=25.10mL,消耗酸为消耗酸为V=![]() =25.00mL;
=25.00mL;
由酸碱中和的实质H++OH-=H2O可知,25.00mL×0.001L/mL×0.1000mol/L=20.00mL×0.001L/mL×c(碱),解得c(碱)=0.1250mol/L;
(3)A.锥形瓶用待测液润洗后再注入待测液,消耗标准溶液偏多,所以结果偏高,A 符合题意;
B.酸式滴定管未用标准液润洗,便装入标准液,标准溶液浓度偏小,所以消耗标准溶液偏多,所以结果偏高,B符合题意;
C.酸式滴定管滴定前俯视读数,滴定后仰视读数,所以消耗标准溶液偏多,所以结果偏高,C符合题意;
D.酸式滴定管滴定前有气泡,滴定后无气泡,所以消耗标准溶液偏多,所以结果偏高,D符合题意;
故合理选项是A、B、C、D。

 导学教程高中新课标系列答案
导学教程高中新课标系列答案【题目】下表为元素周期表的一部分。
碳 | W | Y | |
X | 硫 | Z |
回答下列问题:
(1)表中元素原子半径最大的是___(写元素符号),Z原子核外电子能量最高的电子亚层是____。
(2)下列事实能说明Y元素的非金属性比S元素的非金属性强的是_____。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(3)W的氢化物与F2反应,生成一种铵盐与化合物WF3,WF3的分子构型为三角锥形。
①WF3分子为___〔填“极性”或“非极性”)分子。
②写出该反应的化学方程式,配平并标出电子转移的方向和数目:_____。
(4)硫酸工业生产中接触室内发生的反应方程式为_______;在实际生产中,操作温度选定400~500℃、压强通常采用常压的原因分别是_____。
【题目】某课外活动小组用如图所示的实验装置探究氯气与氨气之间的反应。其中A、F为氨气和氯气的发生装置,C为纯净、干燥的氯气与氨气反应的装置。

备选装置 | ||
|
|
|
Ⅰ | Ⅱ | Ⅲ |
请回答下列问题:
(1)装置F中发生反应的离子方程式是___________________________________。
(2)装置A中的烧瓶内固体可选用________(填字母)。
A.碱石灰 B.浓硫酸 C.生石灰 D.五氧化二磷 E.烧碱
(3)虚线框内应添加必要的除杂装置,请从如图的备选装置中选择,并将编号填入下列空格:
B:________、D:________、E:________。
(4)氯气和氨气在常温下混合就能发生反应生成氯化铵和氮气,该反应的化学方程式为:____________________________________;
(5)装置C内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案确定该白色固体中的阳离子:_______________________________________



