题目内容
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)
已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g。
实验流程:
①往装置A中加入2.7mL(2.3 g)甲苯和125 mL水,然后分批次加入8.5 g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热。
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品。
③纯度测定:称取1.220g白色样品,配成100mL,甲醇溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示列举:
| | 第一次 | 第二次 | 第三次 | 第四次 |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
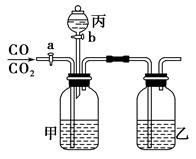
(1)装置A的名称 。若不用温度计,本实验控制反应温度的措施为 。
(2)白色粗产品中除了KCl外,其他可能的无机杂质为 。
(3)操作I的名称 。
(4)步骤③中用到的定量仪器有 ,100mL容量瓶,50mL酸式、碱式滴定管。
(5)样品中苯甲酸纯度为 。
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果 (填“偏大”、“偏小”或“不变”)。
(1)三颈烧瓶,沸水浴加热或者加热保持反应液处于沸腾;
(2)MnCl2
(3)过滤、干燥或抽滤
(4)分析天平
(5)0.9600或96.00%
(6)偏小
解析

练习册系列答案
相关题目
用于提纯或分离物质的方法有:
| A.萃取分液; | B.加热分解; | C.蒸发结晶; | D.分液;E、蒸馏;F、过滤等,请将提纯或分离方法的序号填在后面横线上。 |
(2)分离水和汽油的混合物___
(3)分离相溶的CCl4(沸点:76.75℃)和甲苯(沸点:110.6℃)的混合物_____
为了探究AgNO3的氧化性和热稳定性,某化学兴趣小组设计了如下实验。
Ⅰ. AgNO3的氧化性
将光亮的铁丝伸入AgNO3溶液中,一段时间后将铁丝取出。为检验溶液中Fe的氧化产物,将溶液中的Ag+除尽后,进行了如下实验。可选用试剂:KSCN溶液、NaOH溶液、氯水、KMnO4溶液。
⑴请完成下表:
| 操作 | 现象 | 结论 |
| 取少量除尽Ag+后的溶液于试管中,加入 ,振荡 | | 存在Fe3+ |
| 取少量除尽Ag+后的溶液于试管中,加入1~2滴KMnO4溶液,振荡 | | 存在Fe2+ |
【实验结论】Fe的氧化产物为存在Fe2+和Fe3+
Ⅱ. AgNO3的热稳定性
用下图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束以后,试管中残留固体为黑色。
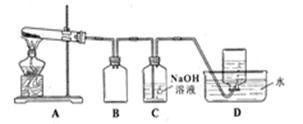
Ⅱ.⑵装置B的作用是 。
⑶经小组讨论并验证该无色气体为O2,其验证方法是 。
⑷【查阅资料】Ag2O和粉末的Ag均为黑色;Ag2O可溶于氨水。
【提出假设】试管中残留的黑色固体可能是:① Ag;② Ag2O;③ Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体,进行了如下实验。
| 实验编号 | 操作 | 现象 |
| a | 加入足量氨水,振荡 | 黑色固体不溶解 |
| b | 加入足量稀硝酸,振荡 | 黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是 (填实验编号)。
【实验结论】根据上述实验结果,得出AgNO3固体受热分解的方程式为 。
【实验拓展】取2.0g AgNO3样品充分受热分解,共收集到标况下气体的体积为336mL,则样品中AgNO3的百分含量为 。