题目内容
盐酸、硫酸和硝酸是中学阶段常见的三种酸。请就三种酸与金属铜反应的情况,回答下列问题。
⑴稀盐酸与同不反应,A同学设想不添加其他试剂,而是设计一个装置来实现以下反应:Cu + 2HCl === CuCl2 + H2↑ 请你画出该装置的示意图。
⑵在100 mL 18 mol·L-'的浓硫酸中加入过量的铜片,加热使之充分反应,得到的气体的物质的量________(填“﹤”、“﹥”或“=”)0.9mol。该反应的化学方程式是________________。
B同学提出,可向反应后的混合物中加入硝酸盐,使剩余的铜片继续溶解,请写出反应的离子方程式:________________________________________________。
(3)W g Cu与V mL过量的浓硝酸反应所得溶液呈绿色。W g Cu与V mL 过量的稀硝酸反应所得溶液呈蓝色。对于溶液颜色的不同,C同学提出可能是Cu2+浓度不同引起的。你是否赞同? _______(填“是”或“否”),理由是_______________________。
D同学认为Cu2+在溶液中应该是蓝色的,绿色是由于生成的NO2与Cu2+共存造成的,请您设计一个实验来检验D同学的假设。写出实验的操作,现象和结论:________________。
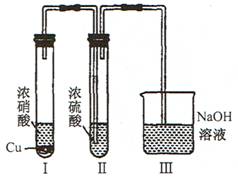
(4)E同学为探究浓硫酸能否作为NO2气体的干燥剂,设计了如图所示的实验,观察到:Ⅱ中溶液变为红棕色,且未有气体逸出。你得出的结论是:__________________________。
⑴图略(画以Cu为阳极,C为阴极,电解质为HCl的电解池即可)(3分)
⑵ Cu + 2H2SO4(浓)![]() CuSO4 + SO2↑ + 2H2O (2分)
CuSO4 + SO2↑ + 2H2O (2分)
Cu + 8H+ + 2NO3- ![]() 3Cu2+ + 2NO↑ + 4H2O (2分)
3Cu2+ + 2NO↑ + 4H2O (2分)
⑶否 (1分)Cu2+的物质的量相同,溶液体积基本相同,则浓度基本相同 (2分)
实验设计 取蓝色Cu(NO3)2溶液,通入NO2,观察是否出现绿色 (2分)
⑷NO2可溶于浓硫酸,不能用浓硫酸干燥NO2(2分)

 盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:
盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就三大酸与金属铜反应的情况,回答下列问题:

