��Ŀ����
����Ŀ����¯�����з����Ļ�����Ӧ֮һ���£�FeO(s) +CO(g)![]() Fe(s)+CO2(g)������Ӧ�����ȷ�Ӧ������֪1100��ʱK=0.263��
Fe(s)+CO2(g)������Ӧ�����ȷ�Ӧ������֪1100��ʱK=0.263��
��1���¶����ߣ���ѧƽ���ƶ���ﵽ�µ�ƽ�⣬��¯��CO2��CO�������ֵ________��ƽ�ⳣ��Kֵ___________ ��ѡ�������С�����䡱����
��2��1100��ʱ��ø�¯��c��CO2��=0.025mol��L��1��c��CO��=0.1mol��L��1������������£��÷�Ӧ�Ƿ��ڻ�ѧƽ��״̬_________ ��ѡ��ǡ�������ʱ����ѧ��Ӧ������v(��)_____ v(��)��ѡ����ڡ���С�ڡ����ڡ�������ԭ����____________��
���𰸡����� ���� �� ���� Qc < K��ƽ��������Ӧ�����ƶ�
��������
��1�������¶�ƽ�������ȷ����ƶ�������ƽ���ƶ��ķ����жϸ�¯��CO2��CO�������ֵ�仯�Լ�ƽ�ⳣ��Kֵ��
��2����Ӧ�����ȷ�Ӧ������Ũ���̣���ƽ�ⳣ���Ƚϣ����жϷ�Ӧ�Ƿ�ﵽƽ��״̬���жϷ�Ӧ���еķ���
��1����ѧ��Ӧ�����ȷ�Ӧ���¶����ߣ���ѧƽ��������У���ѧƽ���ƶ���ﵽ�µ�ƽ�⣬��¯��CO2��CO�������ֵ�������ݻ�ѧƽ�ⳣ������ͼ���ʽ�ж�ƽ�ⳣ�����ʴ�Ϊ����������
��2��1100��ʱ��ø�¯��c��CO2��=0.025molL-1��c��CO��=0.1molL-1������������£��Ѷ���Qc= c��CO2��/ c��CO��=0.025molL-1/0.1molL-1=0.25��K=0.263�����Դ�ʱ��Ӧδ�ﵽ��ѧƽ�⣬��Ӧ������У�����Ӧ���ʴ����淴Ӧ���ʣ��ʴ�Ϊ�����ڣ�Qc < K��ƽ��������Ӧ�����ƶ�

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ��������ͼ��ʾװ�ý�������ʵ�飬�ܵó���Ӧʵ����۵���
ѡ�� | �� | �� | �� | ʵ����� |
|
A | Ũ���� | Na2CO3 | Na2SiO3��Һ | �ǽ����ԣ� C>Si | |
B | ʳ��ˮ | ��ʯ | ��ˮ | ��Ȳ�����巢���ӳɷ�Ӧ | |
C | Ũ���� | Al | NaOH��Һ | ����Ũ���ᷴӦ������NO2 | |
D | Ũ���� | Na2SO3 | KMnO4������Һ | SO2���л�ԭ�� |
A. A B. B C. C D. D
����Ŀ�����������о���Ա������ú��������Ȼ�ѧѭ��ʵ��̫���ܵ�ת����洢���������£�

��1����Ӧ��2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g) ��H1=+551kJmol-1
��Ӧ��S(g)+O2(g)=SO2(g) ��H3=-297kJmol-1
��Ӧ����Ȼ�ѧ����ʽ��____________________��
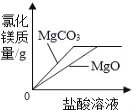
��2���Է�Ӧ����ijһͶ�ϱ�ʱ������ѹǿ�£�H2SO4��ƽ����ϵ�����ʵ����������¶ȵı仯��ϵ����ͼ��ʾ��p2______p1����������������ó��ý��۵�������__________��

��3��I-������Ϊˮ��Һ��SO2�绯��Ӧ�Ĵ��������ܵĴ��������£���ii��������
i��SO2+4I-+4H+=S��+2I2+2H2O
ii��I2+2H2O+______=______+______+2I-
��4��̽��i��ii��Ӧ������SO2�绯��Ӧ���ʵĹ�ϵ��ʵ�����£��ֱ�18 mLSO2������Һ���뵽2mL�����Լ��У��ܱշ��ù۲�������֪��I2���ܽ���KI��Һ�У�
��� | A | B | C | D |
�Լ���� | 0.4molL-1 KI | amolL-1 KI 0.2molL-1H2SO4 | 0.2molL-1H2SO4 | 0.2molL-1 KI 0.0002 molI2 |
ʵ������ | ��Һ��ƣ�һ��ʱ�����ֻ��� | ��Һ��ƣ����ֻ��ǽ�A�� | ������������ | ��Һ���غ�ɫ�ܿ���ɫ����ɻ�ɫ�����ֻ��ǽ�A�� |
�� B��A�ĶԱ�ʵ�飬��a=______��
�ڱȽ�A��B��C���ɵó��Ľ�����______��
��ʵ�������SO2���绯��Ӧ����D��A�����i��ii��Ӧ���ʽ���ԭ��______��