题目内容
【题目】在一定温度下,改变反应物中n(SO2)对反应2SO2(g)+O2(g) 2SO3(g) △H<0的影响如图所示,下列说法正确的是
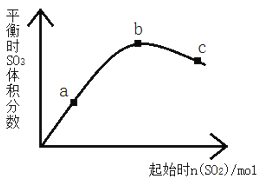
A. 反应b、c点均为平衡点,a点未达平衡且向正反应方向进行
B. a、b、c三点中,a点时SO2的转化率最高
C. 反应a、b、c点均为平衡点,b点时SO2的转化率最高
D. a、b、c三点的平衡常数Kb>Kc>Ka
【答案】B
【解析】
A、题中横坐标为二氧化硫的物质的量,纵坐标为平衡时三氧化硫的体积分数,曲线上的点为平衡状态,故A错误;B、二氧化硫越少,氧气越多,则二氧化硫的转化率越大,a点二氧化硫的转化率最大,故B正确;C、根据B的分析,a点二氧化硫的转化率最大,故C错误;D、温度不变,则平衡常数不变,故D错误;故选B。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】常温下,部分酸的电离平衡常数如下:
化学式 | HF | HCN | H2CO3 |
电离常数 | Ka=3.5×10-4 | Ka=5.0×10-10 | Ka1=4.3×10-7,Ka2=5.6×10-11 |
(1)c (H+)相同的三种酸,其酸的浓度从大到小为____________________。
(2)若HCN酸的起始浓度为0.0lmol/L,平衡时c(H+)约为____________mol/L。若使此溶液中HCN的电离程度增大且c(H+)也增大的方法是____________。
(3)中和等量的NaOH,消耗等pH的氢氟酸和硫酸的体积分别为aL、bL,则a______b (填“大于”、“小于”或“等于”)。中和等浓度、等体积的氢氟酸和硫酸需要NaOH的物质的量为n1、n2,则n1_________n2 (填“大于”、“小于”或“等于”)
(4)向NaCN中通入少量的CO2,发生的离子方程式为____________________。