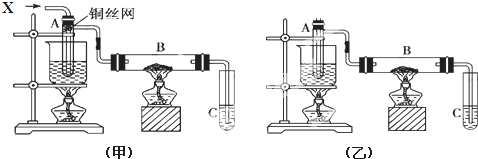
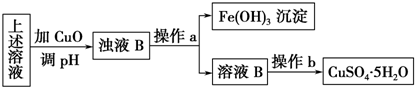
题目内容
1.近年来,某些氢元素的含氢化合物及其复合体系作为氢源受到广泛关注.化合物A(XYH2)和B(XH)都是具有潜在应用价值的释氢材料.A受热分解生成固体化合物C并放出刺激性气体D,D可使湿润的pH试纸变蓝;B中X元素的质量分数为87.5%.A和B混合可优化放氢性能.研究发现,该混合体系的放氢反应分三步进行:(1)2A=C+D (2)D+B=A+H2 (3)C+B=E+H2
(1)X元素的名称为锂.
(2)写出A和B混合放氢的化学反应方程式:2LiNH2+LiH=Li3N+2H2↑.
(3)A、C、E均能水解且生成同样的产物,请写出物质C与水反应的化学方程式:Li2NH+2H2O=2LiOH+NH3↑.
分析 A受热分解生成固体化合物C并放出刺激性气体D,D可使湿润的pH试纸变蓝,则D为NH3,B中X元素的质量分数为87.5%,即$\frac{X}{X+1}$×100%=87.5%,则X=7,即X为Li元素,所以A为LiNH2,B为LiH;
(1)根据以上分析判断;
(2)LiNH2与LiH反应生成Li3N和氢气;
(3)A为LiNH2,LiNH2分解生成氨气和Li2NH,水解生成LiOH和氨气.
解答 解:A受热分解生成固体化合物C并放出刺激性气体D,D可使湿润的pH试纸变蓝,则D为NH3,B中X元素的质量分数为87.5%,即$\frac{B}{B+1}$×100%=87.5%,则B=7,即B为Li元素,所以A为LiNH2,B为LiH;
(1)根据以上分析可知X元素的名称为锂,故答案为:锂;
(2)LiNH2与LiH反应生成Li3N和氢气,其反应的方程式为:2LiNH2+LiH=Li3N+2H2↑,故答案为:2LiNH2+LiH=Li3N+2H2↑;
(3)A为LiNH2,LiNH2分解生成氨气和Li2NH,Li2NH与水反应生成LiOH和氨气,其反应方程式为Li2NH+2H2O=2LiOH+NH3↑,故答案为:Li2NH+2H2O=2LiOH+NH3↑.
点评 本题考查了元素的推断、元素化合物的性质,题目难度中等,把握题目所给信息是解题的关键,侧重于考查学生的分析能力.

练习册系列答案
相关题目
11.下列化学式只表示一种物质的是( )
| A. | C5H12 | B. | C3H8 | C. | C2H4Cl2 | D. | C |
12.能说明A元素非金属性比B元素非金属性强的是( )
| A. | A单质能与B的氢化物水溶液反应,生成B单质 | |
| B. | A元素的最高正价比B元素的最高正价要高 | |
| C. | 气态氢化物溶于水后的酸性:A比B更强 | |
| D. | A原子得到电子的数目比B原子少 |
16.下列的各种说法中,正确的是( )
| A. | 12C的相对原子质量为12g•mol-1 | |
| B. | MgCl2的摩尔质量是95 g | |
| C. | 0.5 mol氢元素约含6.02×1023个氢原子 | |
| D. | 32g O2和O3的混合物中,共有2mol氧原子 |
13.下列对有机物结构或性质的描述,错误的是( )
| A. | 一定条件下,Cl2可在甲苯的苯环或侧链上发生取代反应 | |
| B. | 苯的二氯代物有3种,说明苯分子是由6个碳原子以单双键交替结合而成的六元环结构 | |
| C. | 乙烷和丙烯的物质的量共1 mol,完全燃烧生成3 mol H2O | |
| D. | 光照下2,2-二甲基丙烷与Br2反应,其一溴取代物只有一种 |
11.某一同学根据离子反应方程式2Fe3++Fe═3Fe2+来设计原电池.下列设计方案中可行的是( )
| A. | 电极材料为铁和锌,电解质溶液为FeCl3溶液 | |
| B. | 电极材料为铁和铜,电解质溶液为Fe(NO3)3溶液 | |
| C. | 电极材料为铁和石墨,电解质溶液为FeCl2溶液 | |
| D. | 电极材料为石墨,电解质溶液为FeCl3溶液 |
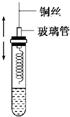 某同学在学习了乙醇的知识后,设计了如图所示的实验.操作步骤及观察到的现象如下:
某同学在学习了乙醇的知识后,设计了如图所示的实验.操作步骤及观察到的现象如下: