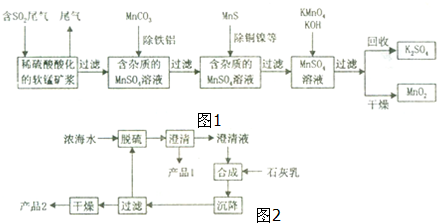
题目内容
5.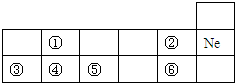 如图是周期表中的一部分:
如图是周期表中的一部分:请回答以下问题:
(1)④的原子结构示意图
 .
.(2)⑤在周期表中的位置第3周期ⅤA族,该族元素的最高正价均为+5.
(3)在①~⑥元素中,原子半径最大的是Al(填元素符号,下同),得电子能力最强的是F.
(4)①和⑥的单质在一定条件反应可生成组成为1:4的化合物,该化合物中化学键的类型为共价键(填“离子键”或“共价键”).
(5)③的单质具有强还原性,与Fe2O3反应可用于焊接钢轨,写出该反应的化学方程式:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
分析 由元素在周期表中位置,可知①为C、②为F、③为Al、④为Si、⑤为P、⑥为Cl.
(1)④为Si,原子核外有12个电子,有3个电子层,各层电子数为2、8、4;
(2)由元素位置可知,⑤位于周期表中第3周期ⅤA族,最高价正化合价等于主族族序数;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大;电负性越强,获得电子能力越强;
(4))①和⑥的单质在一定条件反应可生成组成为1:4的化合物为CCl4;
(5)Al与氧化铁发生铝热反应生成Fe与氧化铝.
解答 解:由元素在周期表中位置,可知①为C、②为F、③为Al、④为Si、⑤为P、⑥为Cl.
(1)④为Si,原子核外有12个电子,有3个电子层,各层电子数为2、8、4,原子结构示意图为: ,故答案为:
,故答案为: ;
;
(2)由元素位置可知,⑤位于周期表中第3周期ⅤA族,最高价正化合价等于主族族序数,故该元素最高正化合价为+5,故答案为:第3周期ⅤA族;+5;
(3)同周期自左而右原子半径减小,同主族自上而下原子半径增大,故上述元素是Al的原子半径最大;由于F元素的电负性最大,故F获得电子能力最强,故答案为:Al;F;
(4))①和⑥的单质在一定条件反应可生成组成为1:4的化合物为CCl4,C原子与Cl原子之间形成共价键,故答案为:共价键;
(5)Al与氧化铁发生铝热反应生成Fe与氧化铝,反应方程式为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe.
点评 本题考查元素周期表与元素周期律应用,难度不大,注意对基础知识的理解掌握.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
15.下列有机物命名不正确的是( )
| A. | 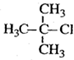 2-甲基-2-氯丙烷 2-甲基-2-氯丙烷 | B. | 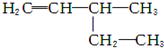 3-乙基-1-丁烯 3-乙基-1-丁烯 | ||
| C. | 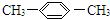 1,4-二甲苯 1,4-二甲苯 | D. | 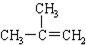 2-甲基丙烯 2-甲基丙烯 |
16.下列事实能说明苯分子没有与乙烯类似的双键的是( )
①苯燃烧时发生明亮并带有浓烟的火焰
②苯在特定条件下能与氢气发生加成反应
③苯不与酸性高锰酸钾溶液或溴水发生反应
④苯分子具有平面正六边形结构,其中6个碳原子之间的键完全相同.
①苯燃烧时发生明亮并带有浓烟的火焰
②苯在特定条件下能与氢气发生加成反应
③苯不与酸性高锰酸钾溶液或溴水发生反应
④苯分子具有平面正六边形结构,其中6个碳原子之间的键完全相同.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ①④ |
13.X、Y、Z均为短周期元素,它们的原子核外最外层电子数分别为1、6、6.Z位于Y的上一周期,则这三种元素形成的某种化合物的化学式可能为( )
| A. | X3YZ4 | B. | X2YZ3 | C. | X2YZ4 | D. | XY2Z3 |
20.芬兰Enfucell公司制造出一种纸质电池(如图所示),避免了传统电池所带来的金属及碱性化合物的泄漏问题,因而可作为一般的家庭废物加以处理.这种被称之为“软电池”的纸质电池,采用一个薄层纸片作为传导体,在其一边镀锌,而在其另一边镀二氧化锰,在纸内的离子“流过”水和氧化锌组成的电解质溶液.电池总反应为:Zn+2MnO2+H2O═2MnO(OH)+ZnO.下列说法正确的是( )

| A. | 该电池的正极为锌 | |
| B. | 该电池反应中二氧化锰起催化剂作用 | |
| C. | 当0.1molZn完全溶解时,流经电解质溶液的电子个数为1.204×1023 | |
| D. | 电池正极反应式为:2MnO2+2e-+2H2O═2MnO(OH)+2OH- |
10.月球的矿产资源极为丰富,仅月面表层5cm厚的沙土就含铁单质有上亿吨,月球上的主要矿物有辉石[CaMgSi2O6]、斜长石[KAlSi3O8]和橄榄石[(Mg或Fe)2SiO4]等,下列说法或分析不正确的是( )
| A. | 辉石、斜长石及橄榄石均属于硅酸盐矿 | |
| B. | 橄榄石中铁为+2价 | |
| C. | 月球表层沙土中有游离态铁是因为月球的表面几乎没有氧气 | |
| D. | 斜长石的氧化物形式可表示为:K2O•Al2O3•3SiO2 |
14.以金红石(主要成分TiO2)为原料生产金属钛的主要步骤是:
①在高温下,向金红石与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃气体;
②在稀有气体(如氩)氛围和加热的条件下,用镁与TiCl4反应可得到钛.
下列说法不正确的是( )
①在高温下,向金红石与焦炭的混合物中通入Cl2,得到TiCl4和一种可燃气体;
②在稀有气体(如氩)氛围和加热的条件下,用镁与TiCl4反应可得到钛.
下列说法不正确的是( )
| A. | 反应①、②均为氧化还原反应 | |
| B. | 在反应①中金红石和焦炭均为还原剂 | |
| C. | 反应①中可燃性气体是CO | |
| D. | 反应②中有1molTi生成时,转移4mol e- |
 病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签信息,回答下列问题(葡萄糖稀溶液的密度约为1g/cm3):
病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签信息,回答下列问题(葡萄糖稀溶液的密度约为1g/cm3):