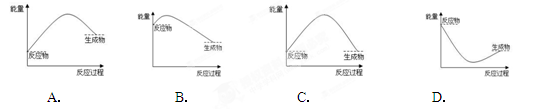
题目内容
下列说法中正确的是
| A.化学反应中的能量变化,表现形式除热量外还可以是光能和电能等 |
| B.化学反应中的能量变化不一定服从能量守恒定律 |
| C.在一个确定的化学反应关系中,反应物的总能量与生成物的总能量可能相同 |
| D.在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量 |
A
解析试题分析:化学反应中的能量变化,表现形式除热量外还可以是光能和电能等,A正确;化学反应中的能量变化一定服从能量守恒定律,B不正确;化学反应中一定伴随能量的变化,所以在一个确定的化学反应关系中,反应物的总能量与生成物的总能量不可能相等,C不正确。在一个确定的化学反应关系中,反应物的总能量可能高于生成物的总能量,也可能低于生成物的总能量,D不正确,答案选A。
考点:考查化学反应中能量变化的有关判断
点评:该题主要是考查学生对化学反应中能量变化,以及影响反应热大小的了解掌握情况,旨在巩固学生的基础,提高学生的应试能力。明确化学反应的特征和影响反应热大小的因素是答题的关键。该题的易错点是选项C。

练习册系列答案
相关题目
下列变化过程,属于放热过程的是
| A.液态水变成水蒸气 | B.酸碱中和反应 |
| C.弱酸电离 | D.NH4Cl晶体与Ba(OH)2·8H2O混合搅拌 |
铁和稀硫酸在敞口容器中进行反应: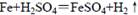 ,下列叙述中不正确的是
,下列叙述中不正确的是
A.该反应的反应过程与能量关系可以用下图表示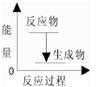 |
| B.若将该反应设计成原电池,当正极产生22.4L气体时,有56g铁溶解 |
| C.若将该反应设计成原电池,溶液中SO42-向Fe电极移动 |
| D.若将该反应设计成原电池,负极发生的反应是:Fe -2e =Fe2+ |
下列关于反应过程中能量变化的说法正确的是
| A.图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) ΔH<0使用和未使用催化剂时,反应过程中的能量变化 |
| B.己知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2。则ΔH1>ΔH2 |
| C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| D.在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1 |
金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石并需要吸收能量。已知12g石墨或金刚石完全燃烧时放出的热量依次为Q 和Q
和Q ,下列说法错误的是
,下列说法错误的是
A.Q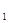 <Q <Q |
| B.石墨不如金刚石稳定 |
| C.质量相等的石墨与金刚石,石墨具有的能量比金刚石低 |
| D.质量相等的石墨与金刚石完全燃烧,生成的二氧化碳一样多 |
下列对化学反应的认识正确的是
| A.化学反应必然引起物质状态的变化 |
| B.化学反应一定有化学键的断裂和生成 |
| C.需要加热的反应一定是吸热反应 |
| D.若反应物的总能量高于生成物的总能量,则该反应是吸热反应 |
已知298 K,101 kPa时,2SO2(g)+O2(g)  2SO3(g);ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是( )
2SO3(g);ΔH=-197 kJ·mol-1。在相同温度和压强下,向密闭容器中通入2 mol SO2和1 mol O2,达到平衡时,放出热量为Q1,向另一个体积相同的容器中通入1 mol SO2,0.5 mol O2和1 mol SO3,达到平衡时放出热量为Q2,则下列关系正确的是( )
| A.Q2<Q1<197 kJ·mol-1 | B.Q2=Q1=197 kJ·mol-1 |
| C.Q1<Q2<197 kJ·mol-1 | D.Q2=Q1<197 kJ·mol-1 |