题目内容
12.下列说法不正确的是( )| A. | 由于Ksp(ZnS)>Ksp(CuS),所以ZnS在一定条件下可转化为CuS | |
| B. | 已知AgCl的Ksp=1.8×10-10,将0.01 mol•L-1KCl溶液和等体积的0.01 mol•L-1 AgNO3溶液混合,有AgCl沉淀析出 | |
| C. | 常温下,为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸 | |
| D. | pH=8的Ba(OH)2溶液和pH=8的氨水中,由水电离的c(OH-)均为1×10-8 mol•L-1 |
分析 A.从难溶电解质的转化的角度分析;
B.如生成沉淀,应满足Qc>Ksp;
C.如HA-电离大于水解,溶液呈酸性,不能说明H2A是强酸;
D.pH=8的Ba(OH)2溶液和pH=8的氨水,c(OH-)=1×10-6 mol•L-1,则水的电离程度相同.
解答 解:A.化学反应可向Ksp小的方向进行,因Ksp(ZnS)>Ksp(CuS),ZnS浊液中加入硫酸铜溶液,可转化为CuS沉淀,故A正确;
B.将0.01 mol•L-1KCl溶液和等体积的0.01 mol•L-1 AgNO3溶液混合,浓度都减小为原来的一半,则5×10-3×5×10-3>1.8×10-10,可生成沉淀,故B正确;
C.如HA-电离大于水解,溶液呈酸性,不能说明H2A是强酸,如H2SO3,故C错误;
D.pH=8的Ba(OH)2溶液和pH=8的氨水,c(OH-)=1×10-6 mol•L-1,则水的电离程度相同,则由水电离的c(OH-)均为1×10-8 mol•L-1,故D正确.
故选C.
点评 本题综合考查难容电解质的溶解平衡以及弱电解质电离,为高频考点,侧重于学生的分析、计算能力的考查,注意把握平衡移动的特点以及计算方法,难度不大.

练习册系列答案
 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案
相关题目
6.运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义.
(1)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ/mol.在T1℃时,反应进行到不同时间(min)测得各物质的浓度(mol/L)如下:
①30min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是ad (填字母编号).
a.通入一定量的NO b.加入一定量的活性炭 c.加入合适的催化剂 d.适当缩小容器的体积
②若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q<0(填“>”或“<”).
(2)某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如1图所示,利用以下反应:NO+CO?N2+CO2(有CO),2NO?N2+O2(无CO)

①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为该反应是放热反应,升高温度反应更有利于向逆反应方向进行;在n(NO)/n(CO)=1的条件下,应控制最佳温度在870℃左右.
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染.写出C2H6与NO2发生反应的化学方程式4C2H6+14NO2$\frac{\underline{\;催化剂\;}}{\;}$8CO2+7N2+12H2O.
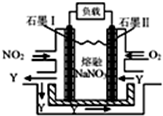
③以NO2、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,则该电极反应式为NO2+NO3--e-=N2O5.
(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)?2CO(g)+2H2(g).
①在密闭容器中通入物质的量浓度均为0.1mol•L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图2所示,则压强P1小于 P2(填“大于”或“小于”);压强为P2时,在Y点:v(正)大于v(逆)(填“大于”、“小于”或“等于”).
②天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X.由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图3,则X的结构简式为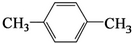 .
.
(1)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g)?N2(g)+CO2(g)△H=Q kJ/mol.在T1℃时,反应进行到不同时间(min)测得各物质的浓度(mol/L)如下:
时间 浓度 | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
a.通入一定量的NO b.加入一定量的活性炭 c.加入合适的催化剂 d.适当缩小容器的体积
②若30min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为3:1:1,则Q<0(填“>”或“<”).
(2)某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如1图所示,利用以下反应:NO+CO?N2+CO2(有CO),2NO?N2+O2(无CO)

①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为该反应是放热反应,升高温度反应更有利于向逆反应方向进行;在n(NO)/n(CO)=1的条件下,应控制最佳温度在870℃左右.
②用CxHy(烃)催化还原NOx也可消除氮氧化物的污染.写出C2H6与NO2发生反应的化学方程式4C2H6+14NO2$\frac{\underline{\;催化剂\;}}{\;}$8CO2+7N2+12H2O.
③以NO2、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,则该电极反应式为NO2+NO3--e-=N2O5.

(3)天然气的一个重要用途是制取H2,其原理为:CO2(g)+CH4(g)?2CO(g)+2H2(g).
①在密闭容器中通入物质的量浓度均为0.1mol•L-1的CH4与CO2,在一定条件下发生反应,测得CH4的平衡转化率与温度及压强的关系如图2所示,则压强P1小于 P2(填“大于”或“小于”);压强为P2时,在Y点:v(正)大于v(逆)(填“大于”、“小于”或“等于”).
②天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃X.由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图3,则X的结构简式为
 .
.
3.25℃下,几种酸的电离平衡常数如表所示,则相关说法不正确的是( )
| 酸 | 醋酸 | 次氯酸 | 亚硝酸 |
| 电离常数 | 1.7×10-5 | 3.0×10-8 | 7.1×10-4 |
| A. | pH相同的氯水和亚硝酸溶液中水电离的c(H+)相同 | |
| B. | 向氯水中滴加氢氧化钠溶液至中性:c(Na+)=2 c(ClO-)+c(HClO) | |
| C. | 向漂白粉溶液中滴加H2SO3溶液可增强其漂白能力 | |
| D. | pH相同的醋酸钠、次氯酸钠和亚硝酸钠溶液中,c(Na+)最大的是亚硝酸钠 |
7.有一瓶无色溶液,可能含有Na+、K+、Al3+、Mg2+、NH4+、Cl-、SO42-、HCO3-、Ba2+、MnO4-中的几种.为确定其成分,进行如下实验:
①取少许溶液,逐渐加入过量的Na2O2固体,产生无色无味的气体和白色沉淀,且白色沉淀逐渐增多后又部分溶解;
②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生;
③用洁净的铂丝蘸取原溶液在酒精灯火焰上灼烧,观察到黄色火焰,
下列推断正确的( )
①取少许溶液,逐渐加入过量的Na2O2固体,产生无色无味的气体和白色沉淀,且白色沉淀逐渐增多后又部分溶解;
②另取部分溶液,加入HNO3酸化的Ba(NO3)2溶液,有白色沉淀产生;
③用洁净的铂丝蘸取原溶液在酒精灯火焰上灼烧,观察到黄色火焰,
下列推断正确的( )
| A. | 由①只能确定溶液中有Al3+、Mg2+,没有HCO3- | |
| B. | 由②知溶液中有SO42-,没有Ba2+ | |
| C. | 由③确定溶液中有Na+,没有K+ | |
| D. | 若检验溶液中是否有存在Cl-,可取少许原溶液,直接向其中加入AgNO3溶液 |
17.在大型演唱晚会上,观众经常使用荧光棒来增添喜庆气氛.荧光棒内草酸二苯酯和过氧化氢反应导致发光的原理大致如下:①草酸二苯酯+H2O2→C2O4+2C6H5OH;②生成的中间产物把能量传递给染料:C2O4+染料→染料*(电子激发态)+2CO2,电子激发态的染料不稳定,借发光而回到基态.下列说法不正确的是( )
| A. | 草酸二苯酯的分子式是C14H10O4 | |
| B. | 上述变化证明化学能可以转化为光能 | |
| C. | C2O4的结构简式 | |
| D. | 反应①属于酯水解反应 |
1.下列物质中只含有共价键的是( )
| A. | H202 | B. | NaCl | C. | NH4CI | D. | AI2O3 |
2.某药物中间体的合成路线如下.下列说法正确的是( )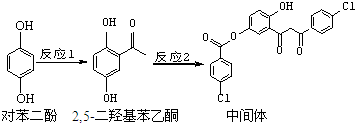

| A. | 对苯二酚在空气中能稳定存在 | |
| B. | 1 mol该中间体最多可与11 mol H2反应 | |
| C. | 2,5-二羟基苯乙酮能发生加成、水解、缩聚反应 | |
| D. | 该中间体分子中含有1个手性碳原子 |
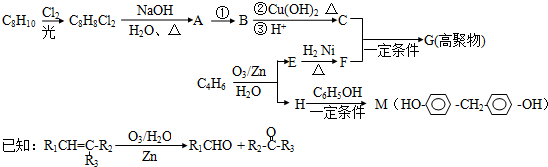
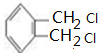
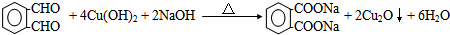
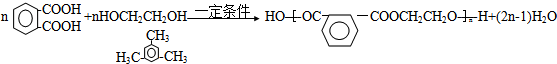
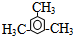 .
. 己知X、Y、Z、W为短周期四种常见元素,其中X是原子半径最小的元素,Y原子的最外层电子数是内层电子数二倍,Z能和X形成两种常见的液态化合物,W元素的单质既能与盐酸反应也能与NaOH溶液反应.元素Q是地壳中含量第二位的金属元素.试回答下列问题:
己知X、Y、Z、W为短周期四种常见元素,其中X是原子半径最小的元素,Y原子的最外层电子数是内层电子数二倍,Z能和X形成两种常见的液态化合物,W元素的单质既能与盐酸反应也能与NaOH溶液反应.元素Q是地壳中含量第二位的金属元素.试回答下列问题: .
.