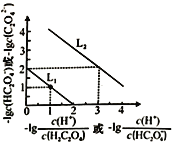
题目内容
【题目】取m g相对原子质量为M的某金属与足量稀硫酸反应,在标准状况下产生a L氢气,该反应生成的硫酸盐中金属元素的化合价为( )
A. +aM/(22.4m) B. +am/(11.2M) C. +11.2m/(aM) D. +aM/(11.2m)
【答案】D
【解析】
金属的物质的量为n=m/Mmol,生成的氢气的物质的量为n=a/22.4mol, 则生成氢气转移的电子数为a/11.2mol。设金属的化合价为x,金属与氢气得失电子数目相等,则m/M![]() x=a/11.2mol,x=+aM/(11.2m)。
x=a/11.2mol,x=+aM/(11.2m)。
金属的物质的量为n=m/Mmol,生成的氢气的物质的量为n=a/22.4mol, 则生成氢气转移的电子数为a/11.2mol。设金属的化合价为x,金属与氢气得失电子数目相等,则m/M![]() x=a/11.2mol,x=+aM/(11.2m)。A. +aM/(22.4m)是错的;B. +am/(11.2M)是错的;C. +11.2m/(aM)是错的;D. +aM/(11.2m)是正确的。答案:D。
x=a/11.2mol,x=+aM/(11.2m)。A. +aM/(22.4m)是错的;B. +am/(11.2M)是错的;C. +11.2m/(aM)是错的;D. +aM/(11.2m)是正确的。答案:D。

 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案【题目】无水四氯化锡(SnCl4)常用作有机合成的氯化催化剂。实验室可用熔融的锡(熔点231.9℃)与Cl2反应制备SnCl4,装置如图所示。回答下列问题:
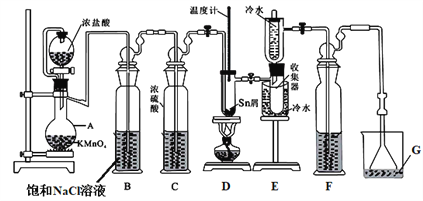
已知:①SnCl4在空气中极易水解生成SnO2·хH2O
②
物质 | 颜色、状态 | 熔点/℃ | 沸点/℃ |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
(1)仪器A的名称是_______________。
(2)Cl2 和锡的反应产物有SnCl4和SnCl2,为防止产品中带入过多的SnCl2,可采取的措施是_____________________________________。
(3)设置试剂F的目的是_______________。
(4)碘氧化法滴定分析产品中2价Sn(II)的含量。准确称取m g产品于锥形瓶中,用蒸馏水溶解,淀粉溶液做指示剂,用c mol·L-1 碘单质标准溶液滴定至终点,消耗碘标准溶液V mL,计算产品中Sn(II)的含量______(用含c、m、V的代数式表示)。
(5)某实验小组甲欲证明由A装置产生的气体中确实含有HCl,设计了如下实验装置。
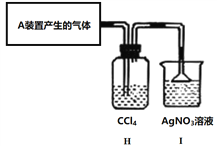
乙小组认为,不能确定进入I装置的气体只有一种。经过充分讨论,乙小组认为可以在不改动装置的前提下,仅替换一种试剂,即可完成论证。请给出改动方案:_____________。